摘要:(2).离子键.共价键,(3)H2O分子之间存在氢键,
网址:http://m.1010jiajiao.com/timu_id_204659[举报]
A、B、C三种常见物质中均含有同一种元素,它们之间有如图1所示的转化关系(部分反应物质已略去).

(1)若A是一种两性氧化物,B的水溶液呈酸性,C的水溶液呈碱性,请写出A、B、C三种物质中含有的同一种金属元素的原子结构示意图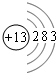
 B溶液显酸性的原因(用离子方程式表示)
B溶液显酸性的原因(用离子方程式表示)
(2)若A为一种金属单质时,反应①②③均为化合反应,反应④为置换反应.请写出③可能的离子方程式
(3)若A、B、C是三种不同类别的固态物质,C是一种既含有离子键又含有共价键的化合物,溶于水电离出两种相同电子数的离子,B是工业上制取A、C的原料.实验室保存少量单质A的方法是
(4)若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液pH<7,将C通入A溶液中,pH值先增大后减小.
①将C通入如图2所示装置中,可以制得强电解质D的溶液,写出气体C发生的电极反应式
②该装置中H+的作用是
③若转移的电子数为6.02×1022时,左槽n(H+)的变化量为
查看习题详情和答案>>

(1)若A是一种两性氧化物,B的水溶液呈酸性,C的水溶液呈碱性,请写出A、B、C三种物质中含有的同一种金属元素的原子结构示意图


Al3++3H2O?Al(OH)3+3OH-
Al3++3H2O?Al(OH)3+3OH-
,反应④的离子方程式Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.(2)若A为一种金属单质时,反应①②③均为化合反应,反应④为置换反应.请写出③可能的离子方程式
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
和工业冶炼A的化学方程式3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(3)若A、B、C是三种不同类别的固态物质,C是一种既含有离子键又含有共价键的化合物,溶于水电离出两种相同电子数的离子,B是工业上制取A、C的原料.实验室保存少量单质A的方法是
通常将Na保存保存在煤油或石蜡油当中
通常将Na保存保存在煤油或石蜡油当中
.写出工业采用B制取C的离子方程式2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
;
| ||
(4)若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液pH<7,将C通入A溶液中,pH值先增大后减小.
①将C通入如图2所示装置中,可以制得强电解质D的溶液,写出气体C发生的电极反应式
2SO2-4e-+4H2O=2SO42-+8H+
2SO2-4e-+4H2O=2SO42-+8H+
②该装置中H+的作用是
使电解质溶液导电
使电解质溶液导电
③若转移的电子数为6.02×1022时,左槽n(H+)的变化量为
0.2mol
0.2mol
.X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为______.
(2)X、Y、Z三种元素第一电离能从大到小顺序为______.
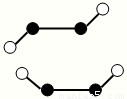
(3)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
①该分子中两个Y原子之间的键型组合正确的是______
A.仅1个σ键B.1个σ键和2个π键
C.1个σ键和1个π键D.仅2个σ键
②该分子中Y原子的杂化方式是______
(4)R2+水溶液中存在配合物离子[R(H2O)4]2+,请画出[R(H2O)4]2+离子的结构式______
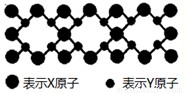
(5)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是______
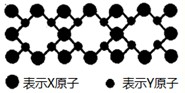
A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键.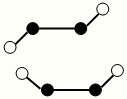
查看习题详情和答案>>
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为______.
(2)X、Y、Z三种元素第一电离能从大到小顺序为______.
(3)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
①该分子中两个Y原子之间的键型组合正确的是______
A.仅1个σ键B.1个σ键和2个π键
C.1个σ键和1个π键D.仅2个σ键
②该分子中Y原子的杂化方式是______
(4)R2+水溶液中存在配合物离子[R(H2O)4]2+,请画出[R(H2O)4]2+离子的结构式______
(5)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是______

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键.

X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为______.
(2)X、Y、Z三种元素第一电离能从大到小顺序为______.
(3)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
①该分子中两个Y原子之间的键型组合正确的是______
A.仅1个σ键B.1个σ键和2个π键
C.1个σ键和1个π键D.仅2个σ键
②该分子中Y原子的杂化方式是______
(4)R2+水溶液中存在配合物离子[R(H2O)4]2+,请画出[R(H2O)4]2+离子的结构式______
(5)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是______
A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键.
 查看习题详情和答案>>
查看习题详情和答案>>
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为______.
(2)X、Y、Z三种元素第一电离能从大到小顺序为______.
(3)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
①该分子中两个Y原子之间的键型组合正确的是______
A.仅1个σ键B.1个σ键和2个π键
C.1个σ键和1个π键D.仅2个σ键
②该分子中Y原子的杂化方式是______
(4)R2+水溶液中存在配合物离子[R(H2O)4]2+,请画出[R(H2O)4]2+离子的结构式______
(5)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是______
A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键.

 查看习题详情和答案>>
查看习题详情和答案>>
(18分)运用物质结构的知识完成下列问题。
(1)第一电离能介于B、N之间的第二周期元素有 (填元素符号)。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,配体的化学式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
Q R
①晶体Q中不存在的作用力为 (填字母)。
A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键
②R中阳离子的空间构型为 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm—(含B、O、H三种元素)的球棍模型如下图3所示。则m= (填数字)。
(5)以四氯化钛、碳化钙、叠氮酸盐(如NaN3)作原料,可以生成碳氮化钛化合物,其结构是用碳原子取代氮化钛晶胞(结构如下图4)所有顶点的氮原子,这种碳氮化钛化合物的化学式为 。

图3 图4
(6)部分化学键的键能见下表:
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
②工业上高纯硅可通过下列反应制取:SiCl4 (g) + 2H2(g) 高温Si(s) + 4HCl(g)
计算该反应的反应热△H =___________ kJ/mol。 查看习题详情和答案>>
(18分)运用物质结构的知识完成下列问题。
(1)第一电离能介于B、N之间的第二周期元素有 (填元素符号)。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,配体的化学式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

Q R
①晶体Q中不存在的作用力为 (填字母)。
A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键
②R中阳离子的空间构型为 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm—(含B、O、H三种元素)的球棍模型如下图3所示。则m= (填数字)。
(5)以四氯化钛、碳化钙、叠氮酸盐(如NaN3)作原料,可以生成碳氮化钛化合物,其结构是用碳原子取代氮化钛晶胞(结构如下图4)所有顶点的氮原子,这种碳氮化钛化合物的化学式为 。


图3 图4
(6)部分化学键的键能见下表:
①比较下列两组物质的熔点高低 (填“>”或“<”) SiC______ Si; SiCl4 ______ SiO2
②工业上高纯硅可通过下列反应制取:SiCl4 (g) + 2H2(g) 高温Si(s) + 4HCl(g)
计算该反应的反应热△H =___________ kJ/mol。
(1)第一电离能介于B、N之间的第二周期元素有 (填元素符号)。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,配体的化学式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

Q R
①晶体Q中不存在的作用力为 (填字母)。
A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键
②R中阳离子的空间构型为 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm—(含B、O、H三种元素)的球棍模型如下图3所示。则m= (填数字)。
(5)以四氯化钛、碳化钙、叠氮酸盐(如NaN3)作原料,可以生成碳氮化钛化合物,其结构是用碳原子取代氮化钛晶胞(结构如下图4)所有顶点的氮原子,这种碳氮化钛化合物的化学式为 。


图3 图4
(6)部分化学键的键能见下表:
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
②工业上高纯硅可通过下列反应制取:SiCl4 (g) + 2H2(g) 高温Si(s) + 4HCl(g)
计算该反应的反应热△H =___________ kJ/mol。