题目内容
A、B、C三种常见物质中均含有同一种元素,它们之间有如图1所示的转化关系(部分反应物质已略去).

(1)若A是一种两性氧化物,B的水溶液呈酸性,C的水溶液呈碱性,请写出A、B、C三种物质中含有的同一种金属元素的原子结构示意图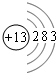
 B溶液显酸性的原因(用离子方程式表示)
B溶液显酸性的原因(用离子方程式表示)
(2)若A为一种金属单质时,反应①②③均为化合反应,反应④为置换反应.请写出③可能的离子方程式
(3)若A、B、C是三种不同类别的固态物质,C是一种既含有离子键又含有共价键的化合物,溶于水电离出两种相同电子数的离子,B是工业上制取A、C的原料.实验室保存少量单质A的方法是
(4)若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液pH<7,将C通入A溶液中,pH值先增大后减小.
①将C通入如图2所示装置中,可以制得强电解质D的溶液,写出气体C发生的电极反应式
②该装置中H+的作用是
③若转移的电子数为6.02×1022时,左槽n(H+)的变化量为

(1)若A是一种两性氧化物,B的水溶液呈酸性,C的水溶液呈碱性,请写出A、B、C三种物质中含有的同一种金属元素的原子结构示意图


Al3++3H2O?Al(OH)3+3OH-
Al3++3H2O?Al(OH)3+3OH-
,反应④的离子方程式Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.(2)若A为一种金属单质时,反应①②③均为化合反应,反应④为置换反应.请写出③可能的离子方程式
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
和工业冶炼A的化学方程式3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(3)若A、B、C是三种不同类别的固态物质,C是一种既含有离子键又含有共价键的化合物,溶于水电离出两种相同电子数的离子,B是工业上制取A、C的原料.实验室保存少量单质A的方法是
通常将Na保存保存在煤油或石蜡油当中
通常将Na保存保存在煤油或石蜡油当中
.写出工业采用B制取C的离子方程式2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
;
| ||
(4)若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液pH<7,将C通入A溶液中,pH值先增大后减小.
①将C通入如图2所示装置中,可以制得强电解质D的溶液,写出气体C发生的电极反应式
2SO2-4e-+4H2O=2SO42-+8H+
2SO2-4e-+4H2O=2SO42-+8H+
②该装置中H+的作用是
使电解质溶液导电
使电解质溶液导电
③若转移的电子数为6.02×1022时,左槽n(H+)的变化量为
0.2mol
0.2mol
.分析:(1)若A是一种两性氧化物,则A为氧化铝,B的水溶液呈酸性,C的水溶液呈碱性,A、B、C三种物质中含有的同一种金属元素,则B为铝盐、C为偏铝酸盐;
(2)若A为金属单质,能连续发生化合反应,容易联想到连续氧化,猜测A为变价金属铁,铁与氯气反应得到氯化铁,氯化铁与铁反应得到氯化亚铁,氯化亚铁与氯气反应得到氯化铁,铁与盐酸发生置换反应可以得到氯化亚铁,也可以是铁与溴的反应;
(3)若A、B、C是三种不同类别的固态物质,C是一种既含有离子键又含有共价键的化合物,溶于水电离出两种相同电子数的离子,考虑10电子微粒,则C为NaOH;B是工业上制取A、C的原料,则B为NaCl、A为Na;
(4)若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液pH<7,A为酸性,将C通入A溶液中,pH值先增大后减小,则A为硫化氢、B为硫、C为二氧化硫.
(2)若A为金属单质,能连续发生化合反应,容易联想到连续氧化,猜测A为变价金属铁,铁与氯气反应得到氯化铁,氯化铁与铁反应得到氯化亚铁,氯化亚铁与氯气反应得到氯化铁,铁与盐酸发生置换反应可以得到氯化亚铁,也可以是铁与溴的反应;
(3)若A、B、C是三种不同类别的固态物质,C是一种既含有离子键又含有共价键的化合物,溶于水电离出两种相同电子数的离子,考虑10电子微粒,则C为NaOH;B是工业上制取A、C的原料,则B为NaCl、A为Na;
(4)若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液pH<7,A为酸性,将C通入A溶液中,pH值先增大后减小,则A为硫化氢、B为硫、C为二氧化硫.
解答:解:(1)若A是一种两性氧化物,则A为氧化铝,B的水溶液呈酸性,C的水溶液呈碱性,A、B、C三种物质中含有的同一种金属元素,则B为铝盐、C为偏铝酸盐,则:
都含Al元素,Al原子结构示意图为: ;铝盐溶液中铝离子水解Al3++3H2O?Al(OH)3+3OH-,破坏水的电离平衡,溶液成酸性;反应④为氧化铝和强碱反应生成偏铝酸盐和水,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
;铝盐溶液中铝离子水解Al3++3H2O?Al(OH)3+3OH-,破坏水的电离平衡,溶液成酸性;反应④为氧化铝和强碱反应生成偏铝酸盐和水,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为: ;Al3++3H2O?Al(OH)3+3OH-;Al2O3+2OH-=2AlO2-+H2O;
;Al3++3H2O?Al(OH)3+3OH-;Al2O3+2OH-=2AlO2-+H2O;
(2)若A为金属单质,能连续发生化合反应,容易联想到连续氧化,猜测A为变价金属铁,铁与氯气反应得到氯化铁,氯化铁与铁反应得到氯化亚铁,氯化亚铁与氯气反应得到氯化铁,铁与盐酸发生置换反应可以得到氯化亚铁(也可以是铁与溴的反应),则:
③可能离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,工业上冶炼铁的方程式为:3CO+Fe2O3
2Fe+3CO2,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;3CO+Fe2O3
2Fe+3CO2;
(3)若A、B、C是三种不同类别的固态物质,C是一种既含有离子键又含有共价键的化合物,溶于水电离出两种相同电子数的离子,考虑10电子微粒,则C为NaOH;B是工业上制取A、C的原料,则B为NaCl、A为Na,则:
实验室保存少量单质A的方法是:通常将Na保存保存在煤油或石蜡油当中,工业采用B制取C的离子方程式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,
故答案为:通常将Na保存保存在煤油或石蜡油当中;2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(4)若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液pH<7,A为酸性,将C通入A溶液中,pH值先增大后减小,则A为硫化氢、B为硫、C为二氧化硫,
①负极上,二氧化硫失电子和水反应生成硫酸,电极反应式为:2SO2-4e-+4H2O=2SO42-+8H+,
故答案为:2SO2-4e-+4H2O=2SO42-+8H+;
②质子膜只允许H+通过,故该装置中H+的作用是使电解质溶液导电,故答案为:使电解质溶液导电;
③若转移的电子数为6.02×1022时,转移电子物质的量为
=0.1mol,由2SO2-4e-+4H2O=2SO42-+8H+,可知左槽n(H+)的变化量=0.1mol×
=0.2mol,
故答案为:0.2mol.
都含Al元素,Al原子结构示意图为:
 ;铝盐溶液中铝离子水解Al3++3H2O?Al(OH)3+3OH-,破坏水的电离平衡,溶液成酸性;反应④为氧化铝和强碱反应生成偏铝酸盐和水,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
;铝盐溶液中铝离子水解Al3++3H2O?Al(OH)3+3OH-,破坏水的电离平衡,溶液成酸性;反应④为氧化铝和强碱反应生成偏铝酸盐和水,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:
 ;Al3++3H2O?Al(OH)3+3OH-;Al2O3+2OH-=2AlO2-+H2O;
;Al3++3H2O?Al(OH)3+3OH-;Al2O3+2OH-=2AlO2-+H2O;(2)若A为金属单质,能连续发生化合反应,容易联想到连续氧化,猜测A为变价金属铁,铁与氯气反应得到氯化铁,氯化铁与铁反应得到氯化亚铁,氯化亚铁与氯气反应得到氯化铁,铁与盐酸发生置换反应可以得到氯化亚铁(也可以是铁与溴的反应),则:
③可能离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,工业上冶炼铁的方程式为:3CO+Fe2O3
| ||
故答案为:2Fe2++Cl2=2Fe3++2Cl-;3CO+Fe2O3
| ||
(3)若A、B、C是三种不同类别的固态物质,C是一种既含有离子键又含有共价键的化合物,溶于水电离出两种相同电子数的离子,考虑10电子微粒,则C为NaOH;B是工业上制取A、C的原料,则B为NaCl、A为Na,则:
实验室保存少量单质A的方法是:通常将Na保存保存在煤油或石蜡油当中,工业采用B制取C的离子方程式为:2Cl-+2H2O
| ||
故答案为:通常将Na保存保存在煤油或石蜡油当中;2Cl-+2H2O
| ||
(4)若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液pH<7,A为酸性,将C通入A溶液中,pH值先增大后减小,则A为硫化氢、B为硫、C为二氧化硫,
①负极上,二氧化硫失电子和水反应生成硫酸,电极反应式为:2SO2-4e-+4H2O=2SO42-+8H+,
故答案为:2SO2-4e-+4H2O=2SO42-+8H+;
②质子膜只允许H+通过,故该装置中H+的作用是使电解质溶液导电,故答案为:使电解质溶液导电;
③若转移的电子数为6.02×1022时,转移电子物质的量为
| 6.02×1022 |
| 6.02×1023mol-1 |
| 8 |
| 4 |
故答案为:0.2mol.
点评:本题考查无机物推断、常用化学用语、原电池及计算等,难度中等,推断物质是解题关键,需要学生对元素化合物知识熟练掌握.

练习册系列答案
相关题目

