题目内容
X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为______.
(2)X、Y、Z三种元素第一电离能从大到小顺序为______.
(3)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
①该分子中两个Y原子之间的键型组合正确的是______
A.仅1个σ键B.1个σ键和2个π键
C.1个σ键和1个π键D.仅2个σ键
②该分子中Y原子的杂化方式是______
(4)R2+水溶液中存在配合物离子[R(H2O)4]2+,请画出[R(H2O)4]2+离子的结构式______
(5)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是______
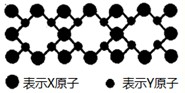
A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键.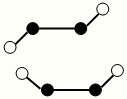
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为______.
(2)X、Y、Z三种元素第一电离能从大到小顺序为______.
(3)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
①该分子中两个Y原子之间的键型组合正确的是______
A.仅1个σ键B.1个σ键和2个π键
C.1个σ键和1个π键D.仅2个σ键
②该分子中Y原子的杂化方式是______
(4)R2+水溶液中存在配合物离子[R(H2O)4]2+,请画出[R(H2O)4]2+离子的结构式______
(5)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是______

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键.

X、Y、Z、Q为短周期非金属元素,R是长周期元素.
X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍,且为非金属,则X为C元素;Y的基态原子有7种不同运动状态的电子,则Y为N元素;
Z元素在地壳中含量最多,则Z为O元素;Q是电负性最大的元素,则Q为F元素;R+离子只有三个电子层且完全充满电子,则R为Cu元素.由分析可知:X为C元素;Y为N元素;Z为O元素;Q为F元素;R为Cu元素.
(1)R为Cu元素,基态原子的电子排布式为1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)同周期元素从左到右元素的第一电离能逐渐减小,则C元素的最小,由于N的2p轨道电子为半充满状态,难以失去电子,
第一电离能大于O,所以第一电离能从大到小的顺序为:N>O>C,故答案为:N>O>C;
(3)Y2Q2为N2F2,有如图2种结构,N原子之间形成N═N双键,①N原子之间形成N═N双键,含有1个σ键和1个π键,故选C;
②杂化轨道数=σ键数+孤对电子对数,该分子中N原子的杂化轨道数=2+1=3,所以N原子杂化方式是sp2杂化,故答案为:sp2杂化;
(4)[R(H2O)4]2+为[Cu(H2O)4]2+,离子结构式为
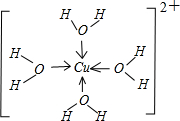
,故答案为:

;
(5)A、X与Y元素可以形成一种超硬新材料,由晶体部分结构可知,该晶体为原子晶体,故A错误;
B、C-N键键长比C-C键长短,C-N键键能大,所以晶体的硬度比金刚石还大,故B正确;
C、结构中每个X原子周围有4个Y原子,每个Y原子周围有3个X原子,所以该晶体化学式为X3Y4,即为C3N4,故C正确;
D、该晶体为原子晶体,晶体熔化时共价键被破坏,没有克服范德华力和氢键,故D正确.
故答案为:BCD.
X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍,且为非金属,则X为C元素;Y的基态原子有7种不同运动状态的电子,则Y为N元素;
Z元素在地壳中含量最多,则Z为O元素;Q是电负性最大的元素,则Q为F元素;R+离子只有三个电子层且完全充满电子,则R为Cu元素.由分析可知:X为C元素;Y为N元素;Z为O元素;Q为F元素;R为Cu元素.
(1)R为Cu元素,基态原子的电子排布式为1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)同周期元素从左到右元素的第一电离能逐渐减小,则C元素的最小,由于N的2p轨道电子为半充满状态,难以失去电子,
第一电离能大于O,所以第一电离能从大到小的顺序为:N>O>C,故答案为:N>O>C;
(3)Y2Q2为N2F2,有如图2种结构,N原子之间形成N═N双键,①N原子之间形成N═N双键,含有1个σ键和1个π键,故选C;
②杂化轨道数=σ键数+孤对电子对数,该分子中N原子的杂化轨道数=2+1=3,所以N原子杂化方式是sp2杂化,故答案为:sp2杂化;
(4)[R(H2O)4]2+为[Cu(H2O)4]2+,离子结构式为

,故答案为:

;
(5)A、X与Y元素可以形成一种超硬新材料,由晶体部分结构可知,该晶体为原子晶体,故A错误;
B、C-N键键长比C-C键长短,C-N键键能大,所以晶体的硬度比金刚石还大,故B正确;
C、结构中每个X原子周围有4个Y原子,每个Y原子周围有3个X原子,所以该晶体化学式为X3Y4,即为C3N4,故C正确;
D、该晶体为原子晶体,晶体熔化时共价键被破坏,没有克服范德华力和氢键,故D正确.
故答案为:BCD.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,X的周期数等于最外层电子数且X属于非金属、Y的最高正价与最低负价之和为0,Q与X同主族;Z、R分别是地壳中含量最高的非金属和金属元素,下列说法正确的是( )
| A、X的原子半径比Z的小 | B、X与Z形成的化合物只有一种 | C、Y的简单氢化物的热稳定性比Z的强 | D、R的最高价氧化物的水化物碱性比Q的强 |
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.有关信息如下表:下列有关说法中正确的是( )
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 最外层电子数是次外层的3倍 |
| Z | 短周期中,其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
| A、原子半径:X>Y>M |
| B、由X、M和氢三种元素不可能形成离子化合物 |
| C、气态氢化物热稳定性:M>X>Y |
| D、Z、Q、M的最高价氧化物对应的水化物可以两两发生反应 |
(14分)R、X、Y、Z、Q、W是六种原子序数依次增大的短周期元素,其相关信息如下表:
|
元素 |
相 关 信 息 |
|
R |
R在周期表中的周期数、族序数与其原子序数均相等 |
|
X |
X原子形成的化合物种类最多 |
|
Y |
Y的氢化物与其最高价氧化物的水化物化合生成一种盐 |
|
Z |
Z原子的最外层电子数为K层电子数的3倍 |
|
Q |
Q存在质量数为23,中子数为12的核素 |
|
W |
W在所处周期中原子半径最小 |
(1)Y的元素名称 ,它在元素周期表中位置是 ;
(2)元素非金属性X比W (填“强”或“弱”); X和W的最高价氧化物对应的水化物中,酸性较强的是 (写化学式)
(3)R与X形成的化合物中,分子中R、X原子个数比为1:1,且分子中只有一种环境的R原子,常温下呈液态,该物质的结构简式是 。R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是 ,请写出该物质的一种主要用途 。