摘要:(4)8Al+3Fe3O4 9Fe+4A12O3
网址:http://m.1010jiajiao.com/timu_id_204506[举报]
 甲、乙、丙、丁是由前20号元素组成的物质,有如下转化:甲+乙→丙+丁
甲、乙、丙、丁是由前20号元素组成的物质,有如下转化:甲+乙→丙+丁(1)若甲为块状固体,丙为分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式
H-C≡C-H
H-C≡C-H
.(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.(3)霍夫曼根据上述反应,用右图实验装置测定了氨分子的组成.打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至2/3处.①滴加浓氨水后试管内的现象
产生大量白烟,黄绿色气体消失
产生大量白烟,黄绿色气体消失
②相应的反应化学方程式8NH3+3Cl2=N2+6NH4Cl
8NH3+3Cl2=N2+6NH4Cl
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式
NCl3
NCl3
,反应方程式3Cl2+NH4Cl═NCl3+4HCl
3Cl2+NH4Cl═NCl3+4HCl
(5)某短周期金属元素的单质与核电荷数为其2倍的金属元素的氧化物之间也能发生上述反应,请写出相应的化学方程式
2Al+3FeO
Al2O3+3Fe或4Al+2Fe2O3
2Al2O3+4Fe或8Al+3Fe3O4
4Al2O3+9Fe
| ||
| △ |
| ||
| △ |
| ||
| △ |
2Al+3FeO
Al2O3+3Fe或4Al+2Fe2O3
2Al2O3+4Fe或8Al+3Fe3O4
4Al2O3+9Fe
.
| ||
| △ |
| ||
| △ |
| ||
| △ |
A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体.甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质.它们之间的转化关系如下图所示:
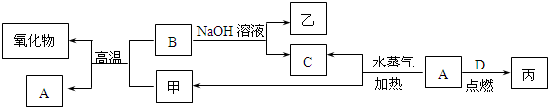
请回答下列问题:
(1)B与甲反应的化学方程式是
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
(4)写出A与水蒸气反应生成C和甲的化学方程式
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是
mol(用含字母的分数式表示).
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为
mol,混合物中A的质量为
×56
×56g(用含字母的分数式表示).
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为
查看习题详情和答案>>

请回答下列问题:
(1)B与甲反应的化学方程式是
3Fe3O4+8Al
9Fe+4Al2O3
| ||
3Fe3O4+8Al
9Fe+4Al2O3
.
| ||
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?
否
否
(填“是”或“否”).(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+
取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+
.(4)写出A与水蒸气反应生成C和甲的化学方程式
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
.
| ||
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
,混合物中B的物质的量为| n |
| 33.6 |
| n |
| 33.6 |
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为
| m |
| 11.2 |
| m |
| 11.2 |
| m-n |
| 22.4 |
| m-n |
| 22.4 |
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为
30%
30%
.(附加题)X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):

(1)当X为金属,Y为非金属时,A是
(2)当X为非金属,Y为金属时,X可能是
(3)当X与Y均为金属时,X与A反应的化学方程式是
(4)当X与Y均为非金属时,若X与Y同主族,X与A反应的化学方程式是
查看习题详情和答案>>

(1)当X为金属,Y为非金属时,A是
镁
镁
(填名称).(2)当X为非金属,Y为金属时,X可能是
H2
H2
或C
C
(均填化学式).(3)当X与Y均为金属时,X与A反应的化学方程式是
8Al+3Fe3O4
9Fe+4Al2O3(或2Al+Fe2O3
2Fe+Al2O3)
| ||
| ||
8Al+3Fe3O4
9Fe+4Al2O3(或2Al+Fe2O3
2Fe+Al2O3)
.
| ||
| ||
(4)当X与Y均为非金属时,若X与Y同主族,X与A反应的化学方程式是
2C+SiO2
Si+2CO↑
| ||
2C+SiO2
Si+2CO↑
.若X与Y不在同一主族,X与A反应的化学方程式是
| ||
C+H2O
H2+CO
| ||
C+H2O
H2+CO
.
| ||
(2011?江西一模)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.
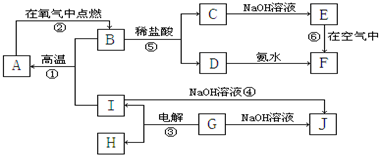
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第
(2)写出反应①的化学方程式
(3)写出D和J的水溶液反应的离子方程式
(4)写出反应③的电极方程式:阳极:
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是
(6)反应④中的氧化剂是
(7)B的化学式:
查看习题详情和答案>>

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第
四
四
周期、第Ⅷ
Ⅷ
族;(2)写出反应①的化学方程式
8Al+3Fe3O4
4Al2O3+9Fe
| ||
8Al+3Fe3O4
4Al2O3+9Fe
;
| ||
(3)写出D和J的水溶液反应的离子方程式
Fe3++3AlO2-+6H2O=Fe(OH)3+3Al(OH)3
Fe3++3AlO2-+6H2O=Fe(OH)3+3Al(OH)3
;(4)写出反应③的电极方程式:阳极:
6O2--12e-=3O2↑
6O2--12e-=3O2↑
;阴极:4Al3++12e-=4Al
4Al3++12e-=4Al
.(5)从能量变化的角度看,①②③反应中属于△H<0的反应是
①②
①②
.(填序号)(6)反应④中的氧化剂是
水
水
.(7)B的化学式:
Fe3O4
Fe3O4
,H的结构式:O=O
O=O
.A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素.
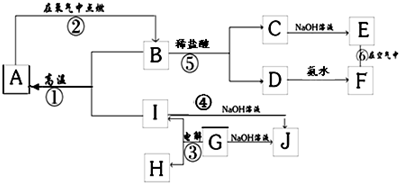
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中的位置是
(2)检验C溶液中阳离子的方法是(写出操作,现象及结论)
(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:
反应④的离子方程式:
反应⑥的化学方程式:
(4)从能量变化的角度看,反应①②③中,属于△H<0的反应是
查看习题详情和答案>>

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中的位置是
第4周期Ⅷ族
第4周期Ⅷ族
.(2)检验C溶液中阳离子的方法是(写出操作,现象及结论)
取少量溶液于试管中,滴加KSCN溶液,溶液无色,滴加氯水,溶液变为血红色证明C溶液中含Fe2+
取少量溶液于试管中,滴加KSCN溶液,溶液无色,滴加氯水,溶液变为血红色证明C溶液中含Fe2+
.(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:
8Al+3Fe3O4
4Al2O3+9Fe
| ||
8Al+3Fe3O4
4Al2O3+9Fe
;
| ||
反应④的离子方程式:
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
;反应⑥的化学方程式:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
;(4)从能量变化的角度看,反应①②③中,属于△H<0的反应是
①②
①②
(填序号).