网址:http://m.1010jiajiao.com/timu_id_204033[举报]
黑钨矿传统冶炼工艺的第一阶段是碱熔法:
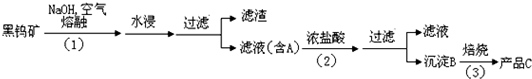
(1)黑钨矿浸入NaOH熔融液过程需通入大量空气,目的是为了使铁和锰转化为氧化物,其中一种红棕色的氧化物化学式为
(2)①已知A的主要成分为Na2WO4,请写出Na2WO4与浓盐酸反应的离子方程式
②上述流程中B、C都是钨的化合物,则步骤(3)中B→C转化属于
(3)钨冶炼工艺的第二阶段则是用碳、氢气等还原剂把氧化钨(WO3)还原为金属钨.对钨的纯度要求不高时,可用碳作还原剂.写出用碳还原氧化钨制取金属钨的化学方程式:
(4)常温下,黑钨矿中FeWO4和MnWO4的溶度积常数分别为:Ksp(FeWO4)=2.5×10-12;Ksp(MnWO4)=7.5×10-16;欲将体积为1L含MnWO4物质的量为0.6mol悬浊液全部转化为FeWO4悬浊液,理论上可往MnWO4悬浊液加入等体积一定浓度的FeCl2溶液完成上述转化;请计算所加入FeCl2溶液浓度为
钼(元素符号Mo)是银灰色的难熔金属,常见化合价为+6、+5、+4,常温下钼在空气中很稳定,高于600 ℃时很快地氧化生成三氧化钼(MoO3);
辉钼精矿(主要成分为MoS2)是生产钼的主要原料。制取过程包括氧化焙烧,三氧化钼、钼粉和致密钼的制取等主要步骤,工艺流程如图:
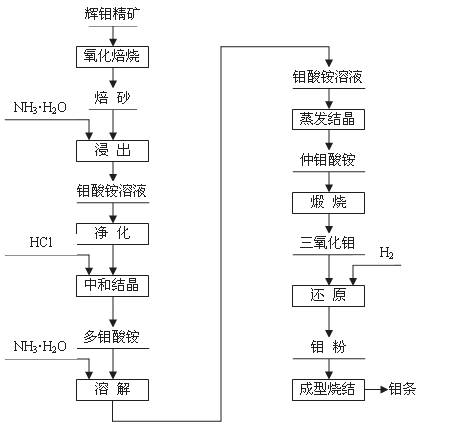
(1)辉钼精矿在600℃下进行氧化焙烧 转化为MoO3,同时产生SO2气体。主要反应的化学方程式为: 。钼冶炼厂对大气的污染主要来自于 ,你认为利用并处理该副产物的最好措施是
;
(2)三氧化钼的制取
将焙砂(主要成分:MoO3)用氨水浸出,与氨水反应生成钼酸铵[(NH4)2MoO4]溶液:反应的离子方程式为: ;
该反应: (填是或不是)氧化还原反应。
将所得钼酸铵[(NH4)2MoO4]溶液加热到55~65 ℃,用盐酸调节至溶液的pH为2,搅拌析出多钼酸铵[(NH4)2O?mMoO3?nH2O]晶体;为除去钙、镁、钠等杂质,将多钼酸铵重新溶于氨水形成钼酸铵,使氨挥发后生成仲钼酸铵晶体[(NH4)2O?7MoO3?4H2O],将仲钼酸铵晶体脱水、煅烧得纯度为99.95%的三氧化钼(MoO3)。
(3)金属钼粉的生产:
工业上在管状电炉中用氢气分两步还原三氧化钼得到钼粉:
① 在450~650℃下: MoO3 + 3H2 === MoO2 + 3H2O
② 在900~950 ℃下:MoO2 + 2H2 === Mo + 2H2O
某同学根据上述还原原理,认为还可用 等还原剂还原MoO3得到钼粉。
查看习题详情和答案>>
(1)写出上述流程中步骤②③中发生反应的化学方程式:
②
③
(2)钨冶炼工艺的第二阶段则是用碳、氢等还原剂把产品C还原为金属钨.对钨的纯度要求不高时,可用碳作还原剂,写出碳还原产品C制取金属钨的化学方程式
(3)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气的理由是
工业上用黄铜矿冶炼铜及对炉渣综合利用的一种工艺流程如下:
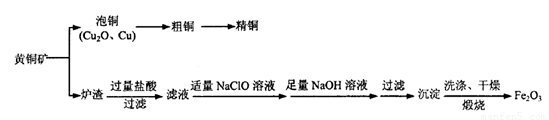
(1)冶炼过程中得到Cu2O和Cu的混合物称为“泡铜”,其与金属A1在高温条件下混合反应可得粗铜,反应化学方程式为________。粗铜精炼时应将粗铜连接在直流电源的____极,可在____极得到纯度较高的精铜。
(2)传统炼铜的方法主要是火法炼铜,其主要反应为:
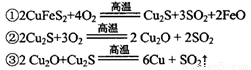
每生成1 mol Cu,共消耗____mol O2。反应③中的氧化剂是____。
(3)炼铜产生的炉渣(含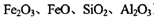 )可制备Fe2O3。根据流程回答下列问题:
)可制备Fe2O3。根据流程回答下列问题:
①加入适量NaClO溶液的目的是_______ (用离子方程式表示)。
②除去Al3+的离子方程式是____。
③选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂有:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水。所选试剂是____。实验设计:________。
查看习题详情和答案>>
工业上用黄铜矿冶炼铜及对炉渣综合利用的一种工艺流程如下:
(1)冶炼过程中得到Cu2O和Cu的混合物称为“泡铜”,其与金属A1在高温条件下混合反应可得粗铜,反应化学方程式为________。粗铜精炼时应将粗铜连接在直流电源的____极,可在____极得到纯度较高的精铜。
(2)传统炼铜的方法主要是火法炼铜,其主要反应为: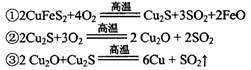
每生成1 mol Cu,共消耗____mol O2。反应③中的氧化剂是____。
(3)炼铜产生的炉渣(含 )可制备Fe2O3。根据流程回答下列问题:
)可制备Fe2O3。根据流程回答下列问题:
①加入适量NaClO溶液的目的是_______ (用离子方程式表示)。
②除去Al3+的离子方程式是____。
③选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂有:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水。所选试剂是____。实验设计:________。