摘要:23.(1)50:1 (2)c(H2SO4) = 1.25 mol?L-1 (3)2.436g
网址:http://m.1010jiajiao.com/timu_id_175995[举报]
高中化学学习阶段,氨的催化氧化反应也可用某金属M(相对原子质量<100)的氧化物做催化剂.M元素的离子在一定条件下能与NH3、卤离子等按某固定比例牢牢结合成稳定的配合物离子(类似于原子团).
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol.该金属M的相对原子质量为 .
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为 mol?L-1.
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO3溶液滴定,达到终点时,耗去AgNO3溶液40.0mL.将B投入过量烧碱溶液中,未检测出NH3的逸出.则B的化学式可表示为 .
(3)已知在图中,L的位置完全相同.现有另一种配离子[M(NH3)6-xClx]n±(1≤x≤5,且x为整数),结构类似图.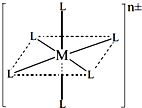
如果该配离子共有2种不同结构,该配离子的式量为 .
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2.则该盐的式量以及物质的量分别为 .
查看习题详情和答案>>
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol.该金属M的相对原子质量为
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO3溶液滴定,达到终点时,耗去AgNO3溶液40.0mL.将B投入过量烧碱溶液中,未检测出NH3的逸出.则B的化学式可表示为
(3)已知在图中,L的位置完全相同.现有另一种配离子[M(NH3)6-xClx]n±(1≤x≤5,且x为整数),结构类似图.

如果该配离子共有2种不同结构,该配离子的式量为
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2.则该盐的式量以及物质的量分别为
小明为研究添加食品中的食盐中的碘酸钾的稳定性,查阅文献得到相关信息如下,回答下列问题
(1)相同温度下,PH=
(2)PH=7时,随着温度的升高碘酸钾的稳定性
(3)小明猜想,碘酸钾因转化为碘单质.请设计一个实验方案证明是否有碘单质生成:
(4)写出一条使用的加碘食盐的合理化建议:
查看习题详情和答案>>
| 编号 | 碘酸钾浓度/mol/L | PH | 碘酸钾损失率/% | |||
| 30℃ | 50℃ | 80℃ | 100℃ | |||
| 1 | 0.003 | 0 | 21 | 70.3 | 71 | 77.3 |
| 2 | 0.003 | 7 | 0 | 0.3 | 0.67 | 1 |
| 3 | 0.003 | 14 | 1.3 | 2.7 | 1.3 | 1 |
0
0
时,碘酸钾最不稳定.(2)PH=7时,随着温度的升高碘酸钾的稳定性
减弱
减弱
(填“增强”,“不变”或“减弱”);(3)小明猜想,碘酸钾因转化为碘单质.请设计一个实验方案证明是否有碘单质生成:
用湿润的淀粉碘化钾试纸检验,如果试纸变蓝色就证明含有碘单质
用湿润的淀粉碘化钾试纸检验,如果试纸变蓝色就证明含有碘单质
;(4)写出一条使用的加碘食盐的合理化建议:
炒好菜再放盐
炒好菜再放盐
.用已知物质的量浓度的酸(或碱)来滴定未知物质的量浓度的碱(或酸)的方法叫酸碱中和滴定.中和滴定实验是以指示剂的变色来表示反应终点的到达.
(1)某学生中和滴定实验的过程如下:
①取一支碱式滴定管;
②用蒸馏水洗净;
③加入待测的NaOH溶液;
④调节起始读数,准确读取读数并记录;
⑤用酸式滴定管精确放出一定量标准酸液;
⑥置于未经标准酸液润洗的洁净锥形瓶中;
⑦加入2滴酚酞试液;
⑧开始滴定,边滴边摇荡;
⑨边注视滴定管内液面变化;
⑩当小心滴到溶液由无色变成粉红色时,即停止滴定;
 记录液面刻度的读数;
记录液面刻度的读数;
 根据滴定管的两次读数得出NaOH溶液的体积为22mL
根据滴定管的两次读数得出NaOH溶液的体积为22mL
指出上述实验过程中的错误之处(填序号) .
(2)现以0.1000mol?L-1 NaOH溶液滴定20.00mL 0.1000mol?L-1HCl溶液为例,讨论强碱滴定强酸的情况,通过计算完成下表(已知:lg2=0.3,lg5=0.7.溶液混合时的体积变化忽略不计):
(3)请利用表的数据绘制滴定曲线.
(4)中和滴定过程中有好多技术问题要学会处理,如:读数时要平视.如果初读数和末读数如图所示,滴定液的用量为 mL.
查看习题详情和答案>>
(1)某学生中和滴定实验的过程如下:
①取一支碱式滴定管;
②用蒸馏水洗净;
③加入待测的NaOH溶液;
④调节起始读数,准确读取读数并记录;
⑤用酸式滴定管精确放出一定量标准酸液;
⑥置于未经标准酸液润洗的洁净锥形瓶中;
⑦加入2滴酚酞试液;
⑧开始滴定,边滴边摇荡;
⑨边注视滴定管内液面变化;
⑩当小心滴到溶液由无色变成粉红色时,即停止滴定;
 记录液面刻度的读数;
记录液面刻度的读数;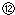 根据滴定管的两次读数得出NaOH溶液的体积为22mL
根据滴定管的两次读数得出NaOH溶液的体积为22mL指出上述实验过程中的错误之处(填序号)
(2)现以0.1000mol?L-1 NaOH溶液滴定20.00mL 0.1000mol?L-1HCl溶液为例,讨论强碱滴定强酸的情况,通过计算完成下表(已知:lg2=0.3,lg5=0.7.溶液混合时的体积变化忽略不计):
| 加入NaOH溶液的体积V/mL | 0.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 剩余盐酸溶液的体积V/mL | 20.00 | 2.00 | 0.20 | 0.02 | 0.00 | / | / | / | / |
| 过量NaOH溶液的体积V/mL | / | / | / | / | / | 0.02 | 0.20 | 2.00 | 20.00 |
| pH | 1.00 | 2.28 | 3.30 | 7.00 | 9.70 | 11.70 | 12.50 |

(4)中和滴定过程中有好多技术问题要学会处理,如:读数时要平视.如果初读数和末读数如图所示,滴定液的用量为
(一)用pH试纸测定溶液pH的正确操作是
(二)某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂.
(1)盛装0.2000mol/L盐酸标准液应该用
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视
(3)滴定操作可分解为如下几步:①检查滴定管是否漏水;②取一定体积的待测液于锥形瓶中;③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)⑤用蒸馏水洗涤玻璃仪器 ⑥滴定操作
正确的操作顺序为:
(4)有关数据记录如下:则NaOH溶液的物质的量浓度为
(5)滴定前平视读数,滴定终点时俯视读数,则会使所测碱的浓度值
(填“无影响”、“偏高”或“偏低”).
查看习题详情和答案>>
用pH试纸测定溶液的pH时的正确做法:撕一小段pH试纸置于表面皿中,用玻璃棒蘸取试液滴在pH试纸上,再与标准比色卡对照读出pH值
用pH试纸测定溶液的pH时的正确做法:撕一小段pH试纸置于表面皿中,用玻璃棒蘸取试液滴在pH试纸上,再与标准比色卡对照读出pH值
(二)某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂.
(1)盛装0.2000mol/L盐酸标准液应该用
酸
酸
式滴定管.(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视
锥形瓶内溶液颜色的变化
锥形瓶内溶液颜色的变化
.(3)滴定操作可分解为如下几步:①检查滴定管是否漏水;②取一定体积的待测液于锥形瓶中;③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)⑤用蒸馏水洗涤玻璃仪器 ⑥滴定操作
正确的操作顺序为:
①⑤③④②⑥
①⑤③④②⑥
.(4)有关数据记录如下:则NaOH溶液的物质的量浓度为
0.2000mol/L
0.2000mol/L
mol/L.| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.55 |
| 2 | 20.00 | 8.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.35 |
偏低
偏低
.(填“无影响”、“偏高”或“偏低”).