摘要:n(CO2 )=0.2mol n(Na2CO3 ) =0.2mol
网址:http://m.1010jiajiao.com/timu_id_17598[举报]
(1)已知可逆反应:M(g)+N(g)?P(g)+Q(g);△H>0,请回答下列问题.
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
②在某温度下起始反应物的浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
(2)盖斯定律在生产和科学研究中有很重要的意义.试根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
(3)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,c(CO32-):c(SO42-)=
[已知Ksp(Ba SO4)=1.3×10-10,Ksp(BaCO3)=2.6×10-9].
查看习题详情和答案>>
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
CF
CF
(填序号).A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
②在某温度下起始反应物的浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
;若保持温度不变,起始反应物的浓度改为:c(M)=4mol?L-1,c(N)=a mol?L-1,达到平衡后,c(P)=2mol?L-1,则a=6
6
mol?L-1.(2)盖斯定律在生产和科学研究中有很重要的意义.试根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
.(3)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,c(CO32-):c(SO42-)=
20:1
20:1
.[已知Ksp(Ba SO4)=1.3×10-10,Ksp(BaCO3)=2.6×10-9].
(14分)以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
4Na(g)+3CO2(g)
 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式: 。
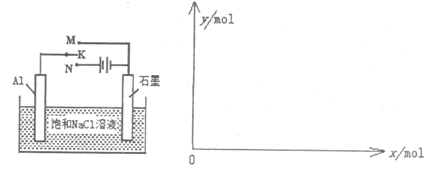
(5)下图开关K接M时,石墨作 极,电极反应式为 。当K接N一段时间后,测得有0.3mol电子转移,作出y随x变化的图象【x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据】
 查看习题详情和答案>>
查看习题详情和答案>>
(14分)以下是一些物质的熔沸点数据(常压):
金属钠和CO2在常压、890℃发生如下反应:
4Na(g)+3CO2(g) 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式: 。
(5)下图开关K接M时,石墨作 极,电极反应式为 。当K接N一段时间后,测得有0.3mol电子转移,作出y随x变化的图象【x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据】

| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
4Na(g)+3CO2(g)
 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式: 。
(5)下图开关K接M时,石墨作 极,电极反应式为 。当K接N一段时间后,测得有0.3mol电子转移,作出y随x变化的图象【x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据】

(1)现有标准状况下8.96LSO2和24gO3,则相同状况下SO2与O3的体积之比为
(2)向100mL2mol/L的NaOH溶液中缓慢通入一定量的CO2.
①当n(CO2)≤0.1mol 时,反应的离子方程式为:
②当0.1mol<n(CO2)<0.2mol时,所得溶液的溶质有
查看习题详情和答案>>
4:5
4:5
,所含氧原子数之比为8:15
8:15
.(2)向100mL2mol/L的NaOH溶液中缓慢通入一定量的CO2.
①当n(CO2)≤0.1mol 时,反应的离子方程式为:
CO2+2OH-=CO32-
CO2+2OH-=CO32-
;②当0.1mol<n(CO2)<0.2mol时,所得溶液的溶质有
Na2CO3、NaHCO3
Na2CO3、NaHCO3
.
请回答:
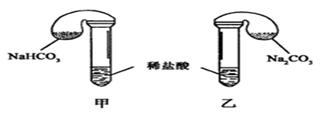
(1)各组反应开始时, 装置中的气球体积先变大,该装置中反应的离子方程式是______。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 组 数 | 试剂用量 | 实验现象 (气球体积变化) | 分析原因 |
| ① | 0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2) |
| ② | 0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| ③ | 0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |