摘要:下表为长式周期表的一部分.其中的编号代表对应的元素.① ② ③ ④ ⑤ ⑥⑦ ⑧ ⑨ ⑩ 请回答下列问题:(1)表中属于d区的元素是 .(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ,③和⑦形成的常见化合物的晶体类型是 .(3)某元素的特征电子排布式为nsnnpn+1.该元素原子的核外最外层电子的孤对电子数为 ,该元素与元素①形成的分子X的空间构形为 .(4)元素③可以形成众多的烃.在烷烃中元素③的杂化方式为 杂化.用VSEPR理论解释③对应的酸根离子中CO32-空间构型为 .(5)某些不同族元素的性质也有一定的相似性.如上表中元素⑤与元素②的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: .(6)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示.1183 K以上转变为图2所示结构的基本结构单元.在两种晶体中最邻近的原子间距离相同.
网址:http://m.1010jiajiao.com/timu_id_174570[举报]
下表为长式周期表的一部分,其中的编号代表对应的元素.
试填空.
(1)写出上表中元素D形成单质的电子式为
 ;
;
(2)元素K基态原子的电子排布式
 ;元素D原子核外的电子占有的轨道数目为
;元素D原子核外的电子占有的轨道数目为
(3)元素M位于周期表的第
(4)G、H、I 这三种元素的第一电离能由大到小的顺序是
(5)元素A、D、J按照原子个数比4:1:1形成的化合物的化学式为
(6)A、C、D 形成的ACD分子中,含有
(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,按半径由小到大排列
(8)某些不同族元素的性质也有一定的相似性,如上表中元素B与元素I的氢氧化物有相似的性质,写出元素B的氢氧化物与NaOH溶液反应后盐的化学式
(9)元素L在一定条件下形成的晶体的基本结构单元如图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:

查看习题详情和答案>>
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | ||||||||||||||
| K | M | L |
(1)写出上表中元素D形成单质的电子式为


(2)元素K基态原子的电子排布式
[Ar]3d54s1
[Ar]3d54s1
;H元素的离子结构示意图

5
5
个.(3)元素M位于周期表的第
ⅤⅢ
ⅤⅢ
族;当将M单质与酸性KMnO4溶液作用时,1个M原子失去3个电子,这些电子分别是在4s、3d
4s、3d
轨道上的;(4)G、H、I 这三种元素的第一电离能由大到小的顺序是
Mg>Al>Na
Mg>Al>Na
(填对应的元素符号);三种元素最高价氧化物对应水化物的碱性由强到弱排列NaOH>Mg(OH)2>Al(OH)3
NaOH>Mg(OH)2>Al(OH)3
(填对应的化学式).(5)元素A、D、J按照原子个数比4:1:1形成的化合物的化学式为
NH4Cl
NH4Cl
,其形成的晶体中含有的化学键类型为离子键和共价键、配位键
离子键和共价键、配位键
.(写出化学键最具体的类别)(6)A、C、D 形成的ACD分子中,含有
2
2
个σ键,2
2
个π键.(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,按半径由小到大排列
Mg2+<Na+<F-<O2-
Mg2+<Na+<F-<O2-
(填对应的离子符号)(8)某些不同族元素的性质也有一定的相似性,如上表中元素B与元素I的氢氧化物有相似的性质,写出元素B的氢氧化物与NaOH溶液反应后盐的化学式
Na2BeO2
Na2BeO2
.(9)元素L在一定条件下形成的晶体的基本结构单元如图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:
2:3
2:3
.两种晶胞中实际含有原子个数之比为1:2
1:2
.
下表为长式周期表的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)图1中属于d区的元素是
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图2所示(图中②、④、⑨分别位于
晶胞的体心、顶点、面心),则该化合物的化学式为
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键D.该氢化物分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为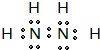
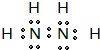 ;该元素还可与元素①形成10电子的气体分子Y(分子量17),将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为
;该元素还可与元素①形成10电子的气体分子Y(分子量17),将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
请回答:表中的金属元素是
查看习题详情和答案>>

请回答下列问题:
(1)图1中属于d区的元素是
⑨
⑨
(填编号).(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图2所示(图中②、④、⑨分别位于
晶胞的体心、顶点、面心),则该化合物的化学式为
MgCNi3或CMgNi3
MgCNi3或CMgNi3
(用对应的元素符号表示).(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
BD
BD
.A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键D.该氢化物分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
1
1
;该元素与元素①形成的18电子的X分子(分子量32)的电子式为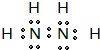
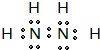
先产生蓝色沉淀,后沉淀消失,变成深蓝色的溶液
先产生蓝色沉淀,后沉淀消失,变成深蓝色的溶液
.(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
DEF
DEF
(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是B的np轨道上的电子半满,能量比A和C低,自身更稳定,所以第一电离能比A和C大
B的np轨道上的电子半满,能量比A和C低,自身更稳定,所以第一电离能比A和C大
.下表为长式周期表的一部分,其中的编号代表对应的元素.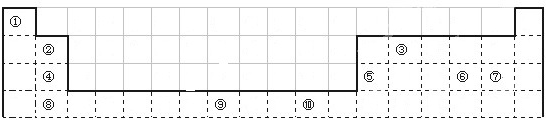
请回答下列问题:
(1)表中属于d区的元素是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
查看习题详情和答案>>

请回答下列问题:
(1)表中属于d区的元素是
⑨
⑨
(填编号).(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
苯
苯
;③和⑦形成的常见化合物的晶体类型是分子晶体
分子晶体
.(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
1
1
;该元素与元素①形成的分子X的空间构形为三角锥形
三角锥形
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
Be(OH)2+2NaOH═Na2BeO2+2H2O
Be(OH)2+2NaOH═Na2BeO2+2H2O
.下表为长式周期表的一部分,其中的编号代表对应的元素.
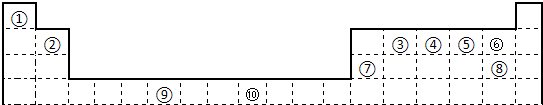
试填空.
(1)写出上表中元素⑨原子的外围电子排布式
(2)元素③与⑧形成的化合物中元素③的杂化方式为:
(3)元素④、⑤的第一电离能大小顺序是:
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应后盐的化学式
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为

查看习题详情和答案>>

试填空.
(1)写出上表中元素⑨原子的外围电子排布式
3d54s1
3d54s1
.(2)元素③与⑧形成的化合物中元素③的杂化方式为:
sp3
sp3
杂化,其形成的化合物的晶体类型是:分子晶体
分子晶体
.(3)元素④、⑤的第一电离能大小顺序是:
N
N
>O
O
(用元素符号表示);元素④与元素①形成的X分子的空间构型为:三角锥形
三角锥形
.请写出与N3-互为等电子体的分子、离子的化学式CO2
CO2
,CNO-
CNO-
(各写一种).(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:
HF分子之间有氢键,能形成缔合分子(HF)n
HF分子之间有氢键,能形成缔合分子(HF)n
.(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应后盐的化学式
Na2BeO2
Na2BeO2
.(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为
2:3
2:3
.
下表为长式周期表的一部分,其中的编号代表对应的元素.
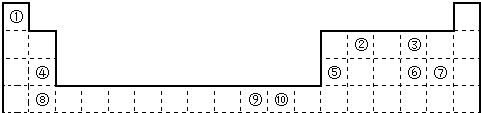
请回答下列问题:
(1)表中属于d区的元素是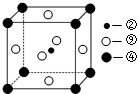
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
(5)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式:
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O6]2+显粉红色.据此判断,[Mn(H2O6]2+
查看习题详情和答案>>

请回答下列问题:
(1)表中属于d区的元素是
⑨
⑨
(填编号).
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
MgCNi3
MgCNi3
(用对应的元素符号表示).(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
BD
BD
.A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
1
1
;该元素与元素①形成的分子X构形为三角锥型
三角锥型
;X在①与③形成的分子Y中的溶解度很大,其主要原因是NH3与H2O都是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂中,且分子之间能形成氢键
NH3与H2O都是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂中,且分子之间能形成氢键
.(5)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式:
1s22s22p63s2
1s22s22p63s2
.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
有
有
颜色(填“无”或“有”).