摘要:21.A.B.C.D.E.F为原子序数依次增大的短周期元素已知A.C.F三种原子的最外电子层共11个电子.且这三种元素的最高价氧化物的水化物之间两两皆能反应.均生成盐和水.D元素的最外层电子数比次外层的电子数少4.E元素原子次外层电子数比最外层电子数多3 (1)写出下列元素的元素符号A D E (2)写出由B.F两种元素形成的化合物的电子式 (3)A.C两种元素高价氧化物的水化物相互反应的离子方程式
网址:http://m.1010jiajiao.com/timu_id_14280[举报]
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
C
D
D
D
A
C
D
C
D
二、选择题
题号
11
12
13
14
15
答案
A
C
B
AC
BC
三、填空、简答和计算
16.(1)NaCl;H2S;N2;NaOH;Na2O2。

17.Na2O, K2S, MgF2, CaCl2
18.(1) ;共价。
;共价。
(2)离子;
(3) ;共价。
;共价。



 (3)NaOH
(3)NaOH 

 、
、

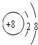
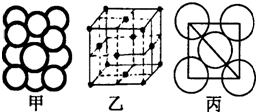 A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.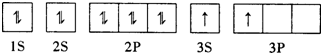
 A、B、C、D、E、F为原子序数依次增大的六种短周期元素.A、D处于同一主族,D、E、F处于同一周期,F原子的最外层电子数是A、B、D原子最外层电子数之和.C2-与D+核外电子层结构相同.A、B组成的常见气体X能使湿润的红色石蕊试纸变蓝;F的单质与X反应能生成B的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;E的单质既能与D元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐N;D、F可组成化合物M.
A、B、C、D、E、F为原子序数依次增大的六种短周期元素.A、D处于同一主族,D、E、F处于同一周期,F原子的最外层电子数是A、B、D原子最外层电子数之和.C2-与D+核外电子层结构相同.A、B组成的常见气体X能使湿润的红色石蕊试纸变蓝;F的单质与X反应能生成B的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;E的单质既能与D元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐N;D、F可组成化合物M.