0 34667 34675 34681 34685 34691 34693 34697 34703 34705 34711 34717 34721 34723 34727 34733 34735 34741 34745 34747 34751 34753 34757 34759 34761 34762 34763 34765 34766 34767 34769 34771 34775 34777 34781 34783 34787 34793 34795 34801 34805 34807 34811 34817 34823 34825 34831 34835 34837 34843 34847 34853 34861 447348
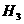 表示
D、它比一个普通氢分子多一个氢原子核
表示
D、它比一个普通氢分子多一个氢原子核 32.一定条件下,可逆反应A2+B2 2C达到了化学平衡状态,经测定平衡时C(A2)=0.5
mol/L,C(B2)=0.1
mol/L,C(C)=1.6
mol/L,若A2、B2、C的起始浓度分别为a mol/L、b mol/L、c mol/L,请回答:
32.一定条件下,可逆反应A2+B2 2C达到了化学平衡状态,经测定平衡时C(A2)=0.5
mol/L,C(B2)=0.1
mol/L,C(C)=1.6
mol/L,若A2、B2、C的起始浓度分别为a mol/L、b mol/L、c mol/L,请回答: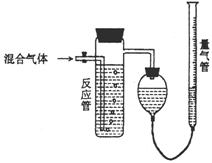 ①混合气体进入反应管中,量气管内增加的水的体
①混合气体进入反应管中,量气管内增加的水的体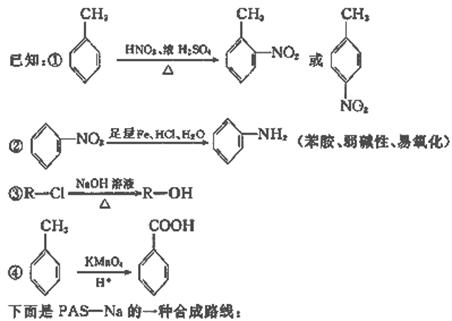
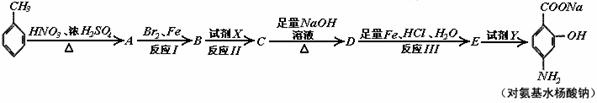
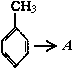
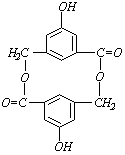 则有机物A的结构简式为____________________。
则有机物A的结构简式为____________________。 26.(5分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
26.(5分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: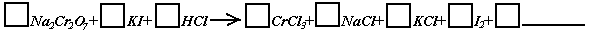
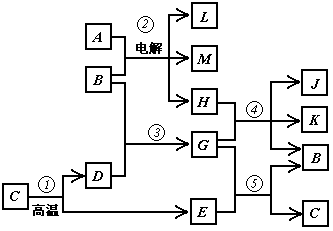 28.(6分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
28.(6分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。