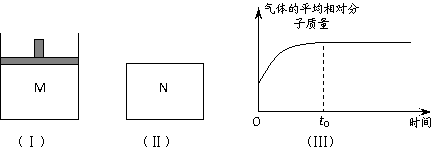
22.(10分)如图Ⅰ,在恒压密闭容器M中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2 A(?)+B(?) x C(g);ΔH<0。平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
x C(g);ΔH<0。平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
⑴根据题中数据计算,x =_________、y =_________;
⑵如图Ⅱ,在体积为V L的恒容密闭容器N中加入和M中相等的A和B发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ,平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,所以z和y的大小也不确定。现根据下表中A、B的状态,请完成z与y的大小关系及M(B)与M(C)的大小关系:
|
可能的情 形 |
A、B是否为气态 |
z与y的大小关系 |
M(B)与M(C)的大小关系 |
|
|
A |
B |
|||
|
① |
是 |
不是 |
|
无法比较 |
|
② |
是 |
是 |
|
无法比较 |
|
③ |
不是 |
是 |
z < y |
|
21.(10分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
|
实验编号 |
C(HA) (mol·L-1) |
C(NaOH) (mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH > 7 |
|
丁 |
0.1 |
0.1 |
pH=8 |
(1).不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________ ___________________________________。
(2).不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2__ ___(填“是”或“否”)。
(3).丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中c(Na+) 、c(A-) 和c(HA) 的浓度由大到小的顺序是____________ ____________________。
(4).写出丁组实验所得混合溶液中下列算式的精确结果(不能作近似计算): c(Na+)与c(A-)的浓度差为_____ ___mol·L-1
 (14分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测
(14分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测 PCl3(g)+Cl2(g) △H >0 K=1
①
PCl3(g)+Cl2(g) △H >0 K=1
① 2C(g)
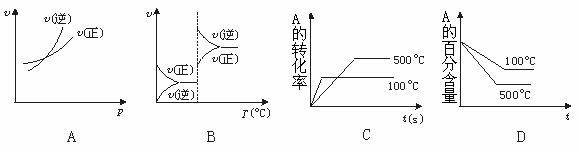
△H>0,下列图象中正确的是( )
2C(g)
△H>0,下列图象中正确的是( )