28、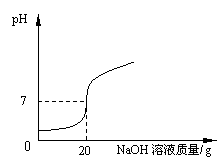 (9分)(1)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定。取废水50 g,用质量分数为2%的氢氧化钠溶液进行中和,如右图所示。请你计算废水中盐酸的溶质质量分数。
(9分)(1)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定。取废水50 g,用质量分数为2%的氢氧化钠溶液进行中和,如右图所示。请你计算废水中盐酸的溶质质量分数。
(写出具体的计算过程)
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究。在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
|
加入盐酸体积V/mL |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
|
测得溶液温度t/℃ |
15.2 |
19.6 |
22.0 |
26.0 |
28.2 |
26.7 |
25.7 |
24.7 |
23.7 |
22.9 |
(2)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线。
(3)根据上述曲线变化讨论溶液温度变化的原因。
① 加入盐酸的量在2-10mL之间时: ;
② 加入盐酸的量在10-20mL之间时: 。
(4)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?答:
26、 (10分)化学老师交给某学校研究性学习小组一个任务:测定实验室里一瓶久置的NaOH固体是否变质。该小组的同学进行了如下实验探究:
[提出问题] 猜想I:没变质,全部是NaOH;
猜想II:部分变质,_____________________;
猜想Ⅲ:完全变质,全部是Na2CO3。
[查阅资料]部分溶液在常温下的pH如下:
|
盐溶液 |
NaCl |
Na2CO3 |
BaCl2 |
|
pH |
等于7 |
大于7 |
等于7 |
[设计方案并进行实验]请你与他们一起共同完成,并回答所给问题。
|
实验步骤 |
实验现象 |
实验结论 |
|
①称取上述氢氧化钠固体样品10.0g溶于100ml,水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应后,静置。 |
产生白色沉淀 |
说明久置固体中,一定含有 (填化学式)。 |
|
②用玻璃棒蘸取少量①中充分反应后的上层清液滴在一小块pH试纸上,与标准比色卡对比,测出pH。 |
pH=11 |
说明久置固体中,还一定含有 (填化学式)。 |
上述步骤①中,称量氢氧化钠固体样品用到的玻璃仪器名称是 ,滴加过量BaCl2溶液的目的是
[实验结论]通过实验,说明上述猜想中 是正确的。
[拓展]该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,
称得其质量为4.0g,则原试剂中NaOH的质量分数为 (保留一位小数)。
[反思]久置的氢氧化钠变质的原因是 (用化学方程式表示)。
25、 (9分)实验室常用氯酸钾晶体和二氧化锰粉末制取氧气(装置A),
(9分)实验室常用氯酸钾晶体和二氧化锰粉末制取氧气(装置A),
也可用过氧化氢溶液和催化剂二氧化锰粉末来制取氧气(装置B)。
装置B中的仪器a是分液漏斗,通过活塞的“开”、“关”可以随时滴加
过氧化氢溶液,从而控制得到氧气的量。
⑴写出一种实验室制取氧气的化学方程式:
_________________________________________________
⑵从反应物状态和反应条件来比较装置A和B的差异:
|
|
装置A |
装置B |
|
反应物状态 |
|
|
|
反应条件 |
|
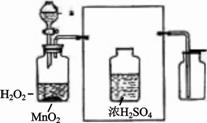 |
⑶用装置B制得的氧气带有少量水蒸气,可用浓硫酸除去水蒸气,
请在右方框中添上带橡皮塞的玻璃导管,补充画出完成除去水蒸
气的实验装置图。
⑷用向上排空气法收集氧气,并用带火星的木条放在集气瓶口
检验氧气是否收集满。这是利用了氧气的______________、______________性质。
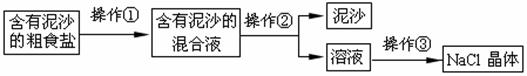
 (3分)碘元素对青少年智力发育影响很大,加碘盐
(3分)碘元素对青少年智力发育影响很大,加碘盐