16.(7分)苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程
由甲苯氧化制备苯甲醛。
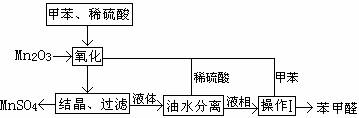
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断的搅拌,搅拌的作用是 。
(2)甲苯经氧化后的得到的混合物通过结晶、过滤进行分离。该过程需要将混合物冷却,
其目的是 。 K^S*5U.C#
(3)实验过程中,可循环使用的物质分别为 、 。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ的名称是 ,其原理是 。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)
|
反应时间/h |
1 |
2 |
3 |
4 |
5 |
|
苯甲醛产率/% |
76.0 |
87.5 |
83.6 |
72.5 |
64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因是 。
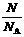 ;n =
;n =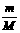
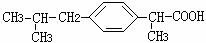
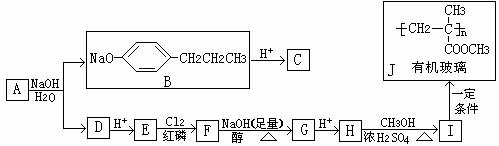
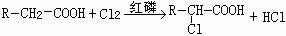

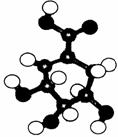 (10分)相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如右图所示。
(10分)相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如右图所示。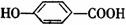 ,试写出该反应的化学方
,试写出该反应的化学方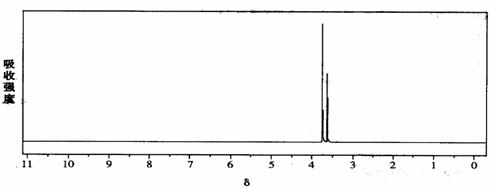

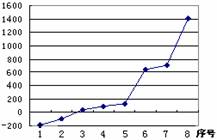 图所示,其中序号“8”代表
(填元素符
图所示,其中序号“8”代表
(填元素符