27. (1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子。
写出甲元素原子的核外电子排布式 。下列各化合物分子中甲元素的原子轨道杂化方式全部相同的是 (填序号)。
a.CH2=CH-C≡CH b.CH2=C(CH3)一CH=CH2 C.C(CH2OH)4
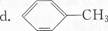
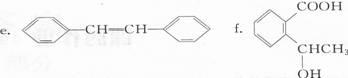
(2)下列现象和应用与电子跃迁无关的是( ).
A.激光 B.焰色反应 C.燃烧放热 D.原子光谱 E.霓虹灯 F.石墨导电
(3)A、B、C三种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍,C元素的基态原子L层有两个未成对电子.
①某直线形分子由A、B两种元素组成且原子个数比为l:1,该分子中含有 个σ键, 个∏键.
②由A、B、C三种元素组成的无机阴离子,可形成二聚离子或多聚链状离子,从该阴离子的结构特点分析能够相互缔合的原因:
(4)CO的结构式可表示为C≡0.N2的结构式可表示为N≡N.下表是两者的键能数据:(单位:kJ·mol_。)
|
|
A-B |
A=B |
A≡B |
|
C≡0 |
357.7 |
798.9 |
1071.9 |
|
N≡N |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因:
(5)Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关.
①Fe(CO)5常温下呈液态.熔点为一20.5℃.沸点为 103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型).
②CuSO5·5H20(胆矾)中含有水合铜离子因而呈蓝色.写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)
24. X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布为nS2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;w元素的电负性略小于Y元素,在w原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ·mol_):
|
Ⅰ1 |
Ⅰ2 |
Ⅰ3 |
Ⅰ4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型为 ,Z2Y2为 晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为 ;XY2的结构式为 ,分子空间构型为
 (3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是
(填“名称”);晶体ZW的熔点比晶体XW4明显高的原因是
。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是
(填“名称”);晶体ZW的熔点比晶体XW4明显高的原因是
。
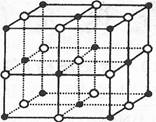
(4)ZW晶体的结构示意图如下。已知ρ(ZW)=2.2 g·cm 一3,NA=6.02×1023 mol-,则ZW晶体中两个最近的Z离子中心间的距离为 。
 2SO3,下列叙述能够说明反应已经达到平衡状态的是
2SO3,下列叙述能够说明反应已经达到平衡状态的是