190.720g) ,利用下图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
|
|
读数次数 |
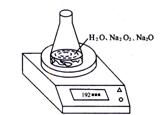 质量/g 质量/g |
|
锥形瓶+水 +试样 |
第l 次 |
192.214 |
|
第2 次 |
192.164 |
|
|
第3 次 |
192.028 |
|
|
第4 次 |
192.010 |
|
|
第5 次 |
192.010 |
(l)写出Na2O2和H2O 反应的化学方程式__________________________________.
(2)计算过氧化钠质量分数时,必需的数据是____________________ (填写必要的数值),不需要第6 次称量的原因_______________________________ ;Na2O2的质量分数为
____________________(填写计算结果)。
(3)测定上述样品(1.560 g)中Na2O2质量分数的另一种方案,其操作流程如下:
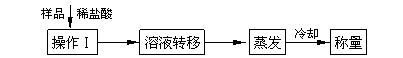

① 操作Ⅰ的名称是_____________________。
② 需直接测定的物理量是_______________、_________________(文字回答)。
③ 测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要_________________、_________________________(固定、夹持仪器除外)。
(4)某同学为测定上述样品(0.1560 g)中Na2O2质量分数,有如下实验装置可供选用:


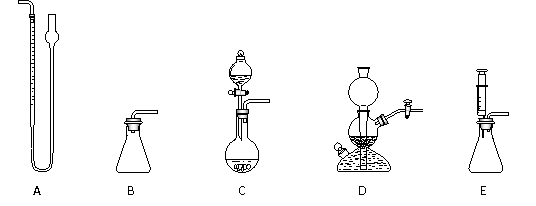

① 为了确保实验的精确度,量气装置选A,则应选取用的发生装置是_____(填编号)。
② 用A装置量气,读数时应进行的操作是____________________________________。
③ 如果量气管的正确读数为50.35 mL,样品的质量为0.1560 g,为了计算样品的质量分数,还需要的数据是________________(文字回答)。
27.有反应 ① Fe(s) + CO2(g)  CO(g) + FeO(s) 的平衡常数为K1;
CO(g) + FeO(s) 的平衡常数为K1;
反应 ② Fe(s) + H2O(g) 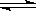 FeO(s) + H2(g) 的平衡常数为K2。
FeO(s) + H2(g) 的平衡常数为K2。
|
温度(K) |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1173 |
2.15 |
X |
在不同温度下K1和K2的值如下表:
(1) 写出K1的平衡常数表达式:K1 = __________。
(2) 反应② 在升高温度时,固体的质量有减小的趋势,据此可判断X的值______2.38(答 > 、<、 =)。
(3) 推导反应:CO2(g)
+ H2(g) 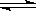 CO(g)
+ H2O(g) 的平衡常数K与K1、K2的关系式K=___________________。
CO(g)
+ H2O(g) 的平衡常数K与K1、K2的关系式K=___________________。
(4) 在10L的密闭容器中加入0.4 mol的CO2和0.2 mol 的H2在一定条件下发生:
CO2(g) + H2(g) 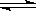 CO(g) + H2O(g)
CO(g) + H2O(g)
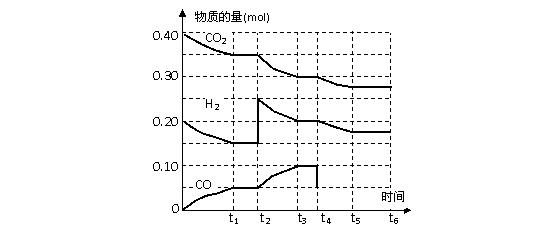 反应中各物质的物质的量与时间的关系如右图所示:反应进行到t2时,曲线发生变化的原因是_______________________________________(文字回答);
反应中各物质的物质的量与时间的关系如右图所示:反应进行到t2时,曲线发生变化的原因是_______________________________________(文字回答);
反应进行到t3时达到平衡,在t4时改变条件,并在t5时重新达到平衡,请在图中用实线画出从t4到t6 时间内CO变化情况。
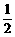 O2(g)
O2(g) 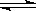 2Z(g),X2、Y2、Z起始浓度分别为0.2mol.L-1 、 0.6mol.L-1 、0.4mol.L-1 ,当平衡时,下列数据肯定不对的是
2Z(g),X2、Y2、Z起始浓度分别为0.2mol.L-1 、 0.6mol.L-1 、0.4mol.L-1 ,当平衡时,下列数据肯定不对的是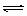 3C + 4D中,表示该反应速率最快的是( )
3C + 4D中,表示该反应速率最快的是( )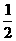 H2O)、无水石膏(CaSO4)三种成分组成,各组分含量可用下列方法测定。
H2O)、无水石膏(CaSO4)三种成分组成,各组分含量可用下列方法测定。