0 29567 29575 29581 29585 29591 29593 29597 29603 29605 29611 29617 29621 29623 29627 29633 29635 29641 29645 29647 29651 29653 29657 29659 29661 29662 29663 29665 29666 29667 29669 29671 29675 29677 29681 29683 29687 29693 29695 29701 29705 29707 29711 29717 29723 29725 29731 29735 29737 29743 29747 29753 29761 447348

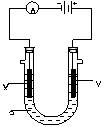 (16分)电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(16分)电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: