20.(10分)已知:反应①Fe(s)+CO2(g)  FeO(s)+CO(g) 平衡常数为K1
FeO(s)+CO(g) 平衡常数为K1
反应②Fe(s)+H2O(g)
 FeO(s)+H2(g) 平衡常数为K2
FeO(s)+H2(g) 平衡常数为K2
反应③H2(g)+CO2(g)  H2O(g)+CO(g) 平衡常数为K3
H2O(g)+CO(g) 平衡常数为K3
测得在不同温度下,K1、K2值如下:
|
温度/℃ |
K1 |
K2 |
|
500 |
1.00 |
3.15 |
|
700 |
1.47 |
2.26 |
|
900 |
2.40 |
1.60 |
(1)若500℃时进行反应①,CO2起始浓度为2mol.L-1,CO2转化率为 。
(2)反应②的焓变△H 0(填>、<、=)。
(3)700℃反应②达到平衡,使得该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号)
A.缩小反应器体积 B.加入水蒸气
C.升高温度到900℃ D.使用合适的催化剂
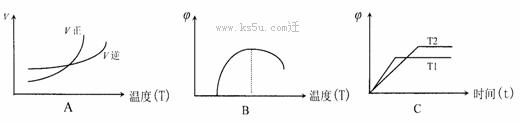 (4)下列图像符合反应①的是
(填序号)(图中v是速率、∅为混合物中CO含量,T为温度)
(4)下列图像符合反应①的是
(填序号)(图中v是速率、∅为混合物中CO含量,T为温度)
(5)900℃进行反应③H2(g)+CO2(g)  H2O(g)+CO(g),其平衡常数K3的数值为
H2O(g)+CO(g),其平衡常数K3的数值为
18.(9分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
① 用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1) 以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)
 (2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入
中。(从下图中选填“甲”或“乙”)
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入
中。(从下图中选填“甲”或“乙”)
(3) 下列操作会引起实验结果偏大的是: (填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶用蒸馏水洗涤后,未用待测液润洗
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
(4) 判断到达滴定终点的现象是:锥形瓶中溶液 。
(5) 以下是实验数据记录表
|
滴定次数 |
盐酸体积mL |
NaOH溶液体积读数(ml) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.00 |
21.30 |
|
2 |
20.00 |
0.00 |
16.30 |
|
3 |
20.00 |
0.00 |
16.22 |
通过计算可得,该盐酸浓度为: mol·L-1(计算结果保留4位小数)
 C.HOOC-- D. -
C.HOOC-- D. - 、Na+、Cl-而不含Al3+,且忽略NaAlO2的水解,则Na2O2、HCl和Al2O3的物质的量之比为
( )
、Na+、Cl-而不含Al3+,且忽略NaAlO2的水解,则Na2O2、HCl和Al2O3的物质的量之比为
( )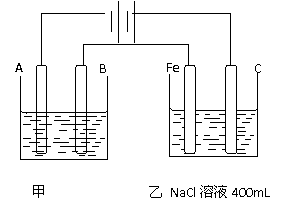 如图,外接电源为Zn-MnO2干电池,甲乙为相互串联的两个电解池,请回答:
如图,外接电源为Zn-MnO2干电池,甲乙为相互串联的两个电解池,请回答: ,
,