本题分A、B两题,A题为“物质结构与性质”模块试题,B题为“化学反应原理”模块试题。邗江中学学生只做B题,其余学生只做A题。
21.(12分)
A.下图是元素周期表中的前四周期,①-⑨为相应的元素,请从中选择合适的元素回答问题:
 ① ① |
|
|
|||||||||||||||
|
|
|
|
② |
③ |
④ |
⑤ |
⑥ |
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
⑦ |
|
|
⑧ |
⑨ |
|
|
|
|
|
|
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表
的 区。
(2)②、⑥两元素形成的化合物的空间构型为 ,其中心原子的杂化类型为 。
(3)写出元素⑧基态原子的电子排布式 。
(4)①③两元素形成的最简单的化合物与 (写微粒符号)互为等电子体。
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于___ 晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力
为 。
(7) 金属⑦的晶体在不同温度下有两种堆积方式,晶胞分 别如右图所示。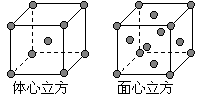 则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
B.(12分)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g)①,25℃时, K=2.95×1011
CH3CH2OH(g)+3H2O(g)①,25℃时, K=2.95×1011
2CO(g)+4H2(g)  CH3CH2OH(g)+H2O(g)②,25℃时, K=1.71×1022
CH3CH2OH(g)+H2O(g)②,25℃时, K=1.71×1022
(1)写出反应①的平衡常数表达式K=__________________。
(2)条件相同时,反应①与反应②相比,转化程度更大的是________。以CO2为原料合成乙醇的优点是 (写出一条即可)。
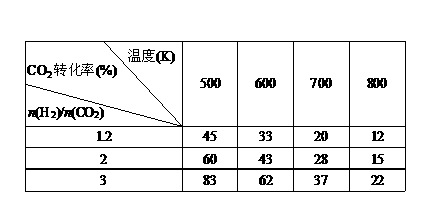 (3)在一定压强下,测得反应①的实验数据如下表:
(3)在一定压强下,测得反应①的实验数据如下表:
根据表中数据分析:
①温度升高,K值______(填“增大”、“减小”或“不变”)。
②提高氢碳比[ n(H2)/n(CO2)],对生成乙醇 (填“有利”、“不利”)。
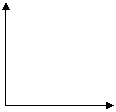 (4)在下图的坐标中作图说明压强变化对反应①的化学平衡的影响。(必须在图中标明坐标轴所表示的物理量。
(4)在下图的坐标中作图说明压强变化对反应①的化学平衡的影响。(必须在图中标明坐标轴所表示的物理量。
扬州市2008-2009学年度高二第一学期期末调研测试
16.(10分)工业制硫酸生产流程如下图:
|
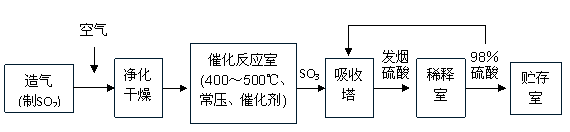

(1)造气阶段,为提高反应的效率,充分利用含硫矿石,请你提出两条可行的措施:
、
|
2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ·mol-1
2SO3(g) ΔH=-196 kJ·mol-1
 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,SO2的浓度是原平衡时的60%,则
达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,SO2的浓度是原平衡时的60%,则
A.平衡向逆反应方向移动了
B.SO2的转化率减小了
C.SO3的质量分数增加了
D.平衡移动过程中,v(逆)< v(正)
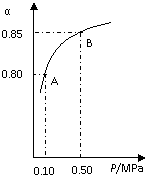
(3)在催化反应室,发生(2)中的反应,已知:某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答:
①将1.0mol SO2和0.05mol O2置于10L密闭容器中,反应达平衡后,若体系总压强为0.10 MPa。该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B) (填“>”、“<”或“=”)。
(4)增大体系的压强能使(2)中平衡向正反应方向移动,但在实际生产中采用了常压的条件,你认为可能的原因是: 。
12.下列叙述正确的是
A.第一电离能: F>O>N
B.苯分子中存在6电子大π键,结构稳定,不能使酸性高锰酸钾溶液褪色
C.CCl4和NH3都是以极性键结合的极性分子
D.白磷为分子晶体,分子结构为正四面体,其键角为109°28′
|
 WI2(g) ΔH<0。下列说法不正确的是
WI2(g) ΔH<0。下列说法不正确的是
A.灯丝附近温度越低,WI2(g)的转化率越高
B.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上
C.该反应的平衡常数表达式是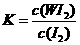
D. 利用该反应原理可以提纯钨
 2Cl2+2H2O。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
2Cl2+2H2O。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。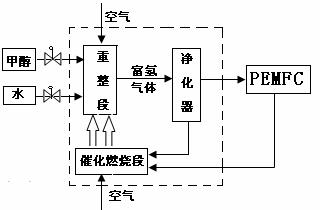 (10分)汽车工业是世界上仅次于石油化工的第二大产业,传统汽车不仅消耗大量的石油资源,而且造成了严重的大气污染,汽车工业正积极寻求新的动力源,燃料电池有可能取代内燃机成为新一代汽车的动力。下图是一种甲醇制氢质子交换膜(PEMFC)燃料电池的工作示意图:
(10分)汽车工业是世界上仅次于石油化工的第二大产业,传统汽车不仅消耗大量的石油资源,而且造成了严重的大气污染,汽车工业正积极寻求新的动力源,燃料电池有可能取代内燃机成为新一代汽车的动力。下图是一种甲醇制氢质子交换膜(PEMFC)燃料电池的工作示意图:
 (1)反应①为
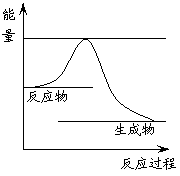
(“放”或“吸”)热反应,右图表示反应①在反应进行过程中能量(单位为kJ·mol-1)的变化示意图。试在答题纸对应的图像中用虚线表示在反应中使用催化剂后能量的变化情况。
(1)反应①为
(“放”或“吸”)热反应,右图表示反应①在反应进行过程中能量(单位为kJ·mol-1)的变化示意图。试在答题纸对应的图像中用虚线表示在反应中使用催化剂后能量的变化情况。
 ②X电极上发生的电极反应式为
。
②X电极上发生的电极反应式为
。 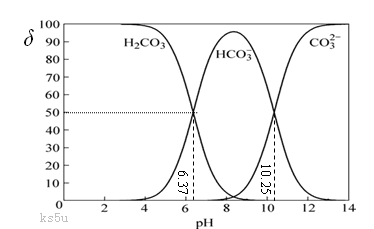
 B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性
B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性 (10分)氢氧化镍是碱性二次电池的正极材料。尿素高温水解是合成Ni (OH )2方法之一。但尿素水解产生的氨很易进入Ni (OH
)2 的结构中。Ni(OH )2 中氨含量高低是评价Ni (OH )2 电化学活性的重要依据。某实验小组测定Ni(OH
)2中氨含量的实验步骤如下:
(10分)氢氧化镍是碱性二次电池的正极材料。尿素高温水解是合成Ni (OH )2方法之一。但尿素水解产生的氨很易进入Ni (OH
)2 的结构中。Ni(OH )2 中氨含量高低是评价Ni (OH )2 电化学活性的重要依据。某实验小组测定Ni(OH
)2中氨含量的实验步骤如下: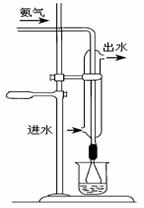 ②滴定:将烧杯中所得吸收液全部转入锥形瓶,向锥形瓶中加入少量水进行稀释并滴入1-2滴甲基红一亚甲基蓝混合指示剂(变色范围5.2-5.6),用NaOH标准溶液滴定剩余的硫酸,当溶液颜色由红紫色转为绿色时,即为滴定终点。
②滴定:将烧杯中所得吸收液全部转入锥形瓶,向锥形瓶中加入少量水进行稀释并滴入1-2滴甲基红一亚甲基蓝混合指示剂(变色范围5.2-5.6),用NaOH标准溶液滴定剩余的硫酸,当溶液颜色由红紫色转为绿色时,即为滴定终点。