5.下列电离方程式中,正确的是
A.CH3COOH=CH3COO- + H+ B.H2SO3 2H+
+SO32-
2H+
+SO32-
C.HCO3-+H2O H3O+
+CO32- D.Na2CO3
H3O+
+CO32- D.Na2CO3 2Na+
+ CO32-
2Na+
+ CO32-
29.实验题(共9分)
(Ⅰ)(3分)某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.1mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
E.用浓度分别为0.50mol/L ,体积各为50mL盐酸、氢氧化钠溶液测定中和热
(Ⅱ)(6分)
用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
|
|
NaOH起始读数 |
NaOH终点读数 |
|
第一次 |
0.10mL |
18.40mL |
|
第二次 |
0.30mL |
18.40mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1 (小数点后保留两位有效数字)。
(2)判断滴定终点的现象是 。
(3)以下操作造成测定结果偏高的原因可能是 (填写序号)。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管
 正极
。
正极
。
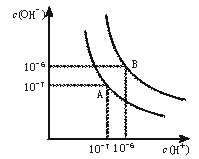 (8分)水的电离平衡曲线如下图所示。
(8分)水的电离平衡曲线如下图所示。