22.某温度下SO2的转化反应的平衡常数K=532.4.
2SO2+O2 2SO3
2SO3
下面三个混合体系中各物质的浓度如下表.试判断各体系中反应进行的方向:
|
体系 |
c(SO2)/mol·L-1 |
c(O2)/mol·L-1 |
c(SO3)/mol·L-1 |
反应方向 |
|
(1) |
0.0600 |
0.400 |
2.000 |
|
|
(2) |
0.0960 |
0.300 |
0.500 |
|
|
(3) |
0.0862 |
0.263 |
1.020 |
|
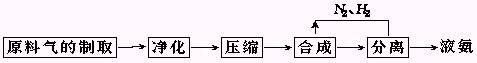
 2NH3(正反应放热),在合成氨工业生产中应采取的适宜条件是( )
2NH3(正反应放热),在合成氨工业生产中应采取的适宜条件是( )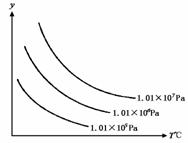
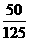 ×100%=40%
×100%=40%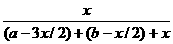 =25%.化简得
=25%.化简得 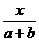 =1/5,故正确答案为A.
=1/5,故正确答案为A.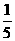 .
.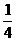 ×100%=18.75%
×100%=18.75%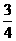 ×100%=56.25%
×100%=56.25%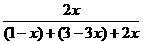 ×100%=25%,x=0.4
×100%=25%,x=0.4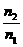 =1.62×107×
=1.62×107×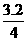 =1.30×107(Pa).
=1.30×107(Pa).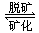 5Ca2++3PO43-+OH-
5Ca2++3PO43-+OH-
 2SO3(正反应放热)
2SO3(正反应放热)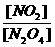 的比值如何变化?
的比值如何变化?