0 25471 25479 25485 25489 25495 25497 25501 25507 25509 25515 25521 25525 25527 25531 25537 25539 25545 25549 25551 25555 25557 25561 25563 25565 25566 25567 25569 25570 25571 25573 25575 25579 25581 25585 25587 25591 25597 25599 25605 25609 25611 25615 25621 25627 25629 25635 25639 25641 25647 25651 25657 25665 447348
 Ca(OH)2+2H2↑其中水的作用是( )
Ca(OH)2+2H2↑其中水的作用是( )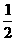 Fe2O3+2NO2+
Fe2O3+2NO2+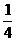 O2
O2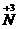 被还原为零价,NH4Cl中
被还原为零价,NH4Cl中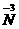 被氧化成零价,所以很快可以配平,即:NaNO2+NH4Cl
被氧化成零价,所以很快可以配平,即:NaNO2+NH4Cl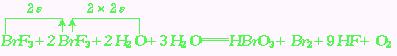
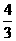 mol+
mol+ mol)=2mol.
mol)=2mol.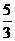 =
=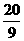 mol,由BrF3还原的BrF3为10/9mol,总的被还原的BrF3为(
mol,由BrF3还原的BrF3为10/9mol,总的被还原的BrF3为(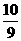 mol)=
mol)=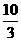 mol.
mol.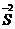 和
和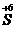 之间的变化,一般是
之间的变化,一般是
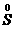 、
、