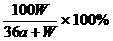0 25254 25262 25268 25272 25278 25280 25284 25290 25292 25298 25304 25308 25310 25314 25320 25322 25328 25332 25334 25338 25340 25344 25346 25348 25349 25350 25352 25353 25354 25356 25358 25362 25364 25368 25370 25374 25380 25382 25388 25392 25394 25398 25404 25410 25412 25418 25422 25424 25430 25434 25440 25448 447348
 4Al
+ 3O2↑
4Al
+ 3O2↑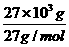 =1×103mol
=1×103mol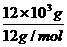 =1×103mol
=1×103mol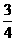 =0.75×103mol.
=0.75×103mol.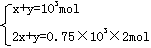
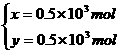 故生成CO2和CO的分子个数比为1∶1
故生成CO2和CO的分子个数比为1∶1
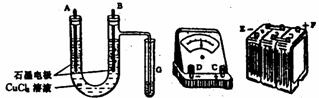
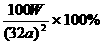 B.
B.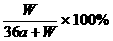 C.
C.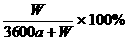 D.
D.