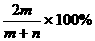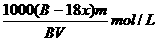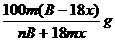23.下列盛放试剂的方法中,正确的是( )
A.把水玻璃盛放在带玻璃塞的试剂瓶里
B.把氢氧化钠溶液盛放在带玻璃塞的试剂瓶里
C.把氢氟酸盛放在玻璃试剂瓶里
D.把氢氧化钾溶液盛放在带橡皮塞的试剂瓶里
⒐下列事实不能用勒夏特列原理解释的是( )
A. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
B. 黄绿色的氯水光照后颜色变浅
C. 使用催化剂可加快SO2转化为SO3的速率
D. 含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡,颜色变浅或褪去。
⒑某有机物的分子式为C5H10O,它能发生银镜反应和加成反应,若将它们与H2加成,所得产物的结构简式可能是( )
A. 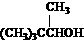 B.
(CH3CH2)2CHOH
B.
(CH3CH2)2CHOH
C. CH3(CH2)3CH2OH D. (CH3)2CHCH2CH2OH
⒒在一个固定体积的密闭容器中,加入2mol A和1mol B发生如下反应:2A(g)+B(g) 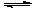 3C(g) +D(s),达到平衡时C的浓度为1.2mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍可能为1.2mol/L的是( )
3C(g) +D(s),达到平衡时C的浓度为1.2mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍可能为1.2mol/L的是( )
A. 4 mol A + 2 mol B
B. 3 mol C + 1 mol D + 1mol B
C. 3 mol C + 0.8 mol D
D. 1.6 mol A + 0.8 mol B + 0.6mol C + 0.3mol D
⒓下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
① C(s) + O2(g)
= CO2(g); C(s)
+  O2(g) =
CO (g);
O2(g) =
CO (g);
② S(s) + O2(g) = SO2(g); S(g) + O2(g) = SO2 (g);
③ H2(g) +  O2(g) = H2O (g); 2H2(g)
+ O2(g)
= 2H2O
(l);
O2(g) = H2O (g); 2H2(g)
+ O2(g)
= 2H2O
(l);
④ CaCO3(s)= CO2(g) + CaO(s); CaO(s) + H2O (l) = Ca(OH)2 (s);
A. ① B. ③④ C. ②③④ D. ①②③
⒔莽草酸(结构简式为 )是一种抗禽流感病毒的成分,下列关于莽草酸的说法,正确的是( )
)是一种抗禽流感病毒的成分,下列关于莽草酸的说法,正确的是( )
A. 遇FeCl3溶液呈紫色 B. 能与Br2发生加成反应
C. 能发生酯化反应 D. 能与Br2发生取代反应生成白色沉淀
⒕某温度下,密闭容器中发生反应 a X (g) 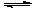 b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )
b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )
A. 可逆反应的化学计量数:a>b+c
B. 压缩容器的容积时,υ正增大,υ逆减小
C. 达到新平衡时,物质X的转化率减小
D. 达到新平衡时,混合物中Z的质量分数增大
⒖1-溴丙烷和2-溴丙烷分别与NaOH乙醇溶液共热的反应( )
A. 产物相同 B. 产物不同
C. 碳氢键断裂的位置相同 D. 碳氢键断裂的位置不同
第Ⅱ卷(非选择题,共46分)
⒗(每空2分,共12分。)
某化学反应 2A(g) 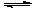 B(g) +D(g) 在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度随反应时间的变化情况如下表:
B(g) +D(g) 在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度随反应时间的变化情况如下表:
|
实验 序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800 |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800 |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800 |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820 |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:(实验序号1以⑴代表,余同。)
①在⑴中,反应在10至20 min 内平均速率υ 为 mol·L-1·min-1;
②在⑵中,A的初始浓度c2 = mol·L-1。
③设⑶的反应速率为υ3,⑴的反应速率为υ1,则υ3 υ1(填>、=、<)且c3 1.0 mol·L-1(填>、=、<)。
④比较⑷和⑴,可推测该反应是 反应(选填“吸热”、“放热”)。理由是
。
⒘(每空2分,共4分。)
⑴发射“神州六号”载人飞船的长征火箭是用肼(N2H4)燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g) + 2O2(g) = 2NO2(g) △H=67.7 kJ·mol-1;
N2H4(g) + O2(g) = N2(g) + 2H2O (g) △H=-534 kJ·mol-1;
肼与二氧化氮反应的热化学方程式为 。
⑵已知下列反应:
H2(g) = 2H(g) △H1=+Q1 kJ·mol-1;
O2(g) = 2O(g) △H2=+Q2 kJ·mol-1;
2H(g) +O(g) = H2O (g) △H3=-Q3 kJ·mol-1;
H2O (g) = H2O (l) △H4=-Q4 kJ·mol-1;
H2(g)
+  O2(g) = H2O (l) △H5=-Q5 kJ·mol-1;
O2(g) = H2O (l) △H5=-Q5 kJ·mol-1;
试指出Q1、Q2、Q3、Q4、Q5的等量关系: 。
⒙(每空2分,共6分。)
⑴设计实验证明溴乙烷在NaOH水溶液中发生取代反应(即溴乙烷里的Br变成了Br―)
。
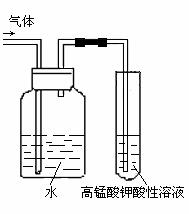 ⑵将溴乙烷与NaOH乙醇溶液的反应生成的气体进行
⑵将溴乙烷与NaOH乙醇溶液的反应生成的气体进行
检验。有人设计了如图实验方案。请回答:
气体通入KMnO4酸性溶液前加一个盛有水的洗气瓶,
其中洗气瓶中水的作用是 ,
其原因是
。
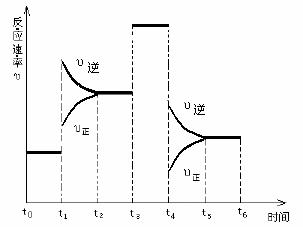 ⒚(每空2分,共10分。)
⒚(每空2分,共10分。)
一密闭容器中发生下列反应
N2+3H2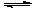 2NH3;△H<0,
2NH3;△H<0,
右图是某一时间段中反应速率与
反应进程的曲线关系图。回答:
⑴处于平衡状态的时间段是 。
⑵t1、t3、t4时刻,体系中分别是什么条件发生了什么变化?
、
、
。
⑶下列时间段中,氨的百分含量最高的是
A. t0-t1 B. t2-t3 C. t3-t4 D. t5-t6
⒛(每空2分,共16分。)
A是一种可以作为药物的有机物。请根据下图所示的转化关系,回答问题
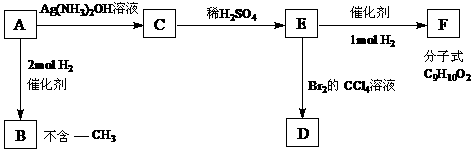
⑴写出A、B、F的结构简式:A B F
⑵写出下列变化的化学方程式,并注明反应类型。
A → C
反应类型
E → D
反应类型
⑶B的一种同分异构体只含一个-CH3,且1mol该物质能与浓Br2水反应,共消耗3mol Br2。则该有机物的结构简式为 。
第一学期期终教学质量检测




 W
W
W
W
W
W
W
W 

 V
V
V
V
V
V
V
V