13.(12分)在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格:
|
时间(s) 浓度 (mol·L-1) |
0 |
20 |
40 |
60 |
80 |
100 |
|
C(N2O4) |
0.100 |
C1 |
0.050 |
C3 |
a |
b |
|
C(NO2) |
0.000 |
0.060 |
C2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为 ,达到平衡时,四氧化二氮的转化率为 ,表中C2 C3,a b(填“>” 、“<” 或“=” )
(2)20s时四氧化二氮的浓度C1= mol·L-1,在0-20s时间段内,四氧化二氮的平均反应速率为
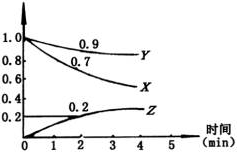
14.(10分) 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。
(1)由图中数据分析:该反应的化学方程式为 。
(2)反应开始至2min,用Z表示的平均反应速率为 。用X表示的平均反应速率为 。
(3)判断:第5分钟时,反应是否达到平衡?_______.第5分钟时,Z的生成速率与Z的消耗速率相比_________(填”大”、“小”或“相等”)
11.(12分))回答有关氯气制备的几个问题
实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。现有两个同学分别设计的两套实验装置如下图:
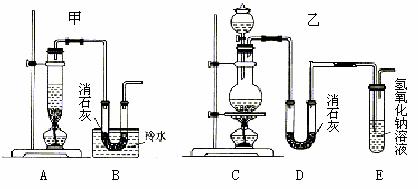
(1)写出制取氯气的化学方程式 。
(2)请从以下几个方面对甲乙两套实验装置的优缺点作出评价,并将符合题目要求的
选项的序号填在表格中。
a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可防止副反应发生;e.污染环境;f.可防止污染环境。
|
|
优 点 |
缺 点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分连接顺序是 (按气流流动的方向) 。该组合中还缺少的装置是 ,原因是 。
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯酸钙的物质的量最多不超过 mol。
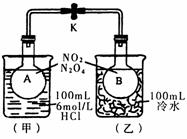 12(6分).如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放100 mL 6 mol/L的HCl溶液,烧杯乙中盛放100 mL冷水。现向烧杯甲的溶液中放入25 g NaOH固体,同时向烧杯乙中放入25 g NH4NO3固体,搅拌使之溶解。
12(6分).如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放100 mL 6 mol/L的HCl溶液,烧杯乙中盛放100 mL冷水。现向烧杯甲的溶液中放入25 g NaOH固体,同时向烧杯乙中放入25 g NH4NO3固体,搅拌使之溶解。
⑴A瓶中气体颜色 ,理由是 。
⑵B瓶中气体颜色 ,理由是 。
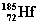 (铪),它的中子数是( )
(铪),它的中子数是( ) 反应A(g)+3B(g) 2C(g)+ 2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
反应A(g)+3B(g) 2C(g)+ 2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是