24.(10分)某学生为了探究Zn与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的Zn粉,用排水集气法收集反应放出的H2,实验记录如下(累计值):
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0-1、1-2、2-3、3-4、4-5 min)反应速率最大 ,你认为原因是 ;高*考*资*源*网
(2)4-5 min时间段的反应速率最小,你认为原因是 ;
 (3)求2-3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=
;
(3)求2-3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=
;
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质: A.H2O B.NaCl溶液 C.Na2CO3溶液 D.Cu粉 E.CuSO4粉末;
你认为可行的是(填编号) 。
20.普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入
MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-
= 2NH3+H2。根据以上所述判断下列结论不正确的是
A.工作时Zn为负极,发生还原反应
B.工作时电流由碳极经外电路流向Zn极
C.输出电流时碳棒上发生还原反应
D.长时间使用后内装糊状物可能流出,腐蚀用电器
第Ⅱ卷(非选择题,共55分)高*考*资*源*网
|
|
|
|
(1)当x-y=10时,该粒子为 (选填“原子”或“阳离子”、“阴离子”);
(2)当y=8时,该粒子可能是(用化学式表示,任填3种) 、 、 ;
(3)请写出工业上制取y=7元素对应单质时的离子方程式:
。
19.某条件下在密闭容器中发生反应X2 +
3Y2 2Z2 ,右图是反应过程中,反应速
2Z2 ,右图是反应过程中,反应速

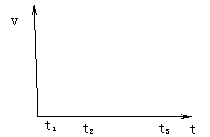 率(v)与时间(t)的关系曲线,下列叙述正确的是
率(v)与时间(t)的关系曲线,下列叙述正确的是
|
 进行而减小
进行而减小

|
|
反应不再进行
D.从关系曲线可知,反应开始时体系中只有X2和Y2
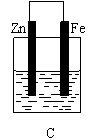
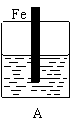
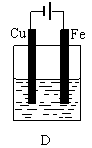 (10分)某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。
(10分)某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。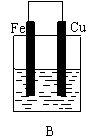
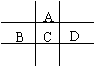 E的阳离子与A的阴离子核外电子层结构相同。
E的阳离子与A的阴离子核外电子层结构相同。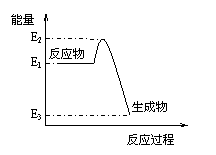 根据右图提供的信息,下列所得结论正确的是
根据右图提供的信息,下列所得结论正确的是 D.该反应向外界放出的热量为E2-E3
D.该反应向外界放出的热量为E2-E3 2NH3(g)
△H=-92.4 kJ·mol-1,则说明相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放热92.4 kJ
2NH3(g)
△H=-92.4 kJ·mol-1,则说明相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放热92.4 kJ