21. 经测定乙醇的化学式是C2H6O,由于有机物普遍存在同分异构现象,推测乙醇的结构可能是下列两种之一。
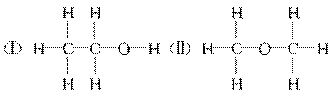
为测定其结构,应利用物质的特殊性进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四位同学直接利用如图给定装置开始进行实验确定乙醇的结构。
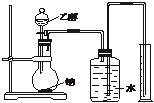
(1)学生甲得到一组实验数据:
|
乙醇的物质的量/mol |
氢气的体积/L |
|
0.10 |
1.12(标准状况) |
根据以上数据推断乙醇的结构为 (用Ⅰ、Ⅱ表示),理由为
(2)同学乙分别准确称量4.60 g 乙醇进行多次实验,结果发现以排开量筒内的体积作为生成的H2体积,换算成标准状况后都小于1.12L,如果忽略量筒本身及乙同学读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗? (填“正确”或“不正确”)。如果你认为正确,请说明理由;如果你认为不正确,那产生这种情况的原因应该是什么?
(3)同学丙认为实验成功的关键有:①装置气密性要良好,②实验开始前准确确定乙醇的量,③钠足量,④广口瓶内水必须充满,⑤氢气体积的测算方法正确、数据准确。其中正确的有 。(填序号)
(4)同学丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需要知道的数据是 。
(5)实验后,四名同学从乙醇的可能结构分析入手,对乙醇和钠的量的关系进行了讨论,如果乙醇的物质的量为n mol,那么对钠的物质的量的取值要求必须是 。
16.当干冰气化时,下列所述中发生变化的是 ( )
A.分子间距离 B.、范德华力 C.分子内共价键 D.化学性质
|
|
|
|
|
 有很相似的结构,它与石墨互为
( )
有很相似的结构,它与石墨互为
( ) 下列反应既是氧化还原反应,又是放热反应的是
( )
下列反应既是氧化还原反应,又是放热反应的是
( ) 

 盐酸发生反应时的情景,产生CO2气体的体积较多的试
盐酸发生反应时的情景,产生CO2气体的体积较多的试

 A.周期表是按原子量逐渐增大的顺序从左到右排列的
A.周期表是按原子量逐渐增大的顺序从左到右排列的