0 17880 17888 17894 17898 17904 17906 17910 17916 17918 17924 17930 17934 17936 17940 17946 17948 17954 17958 17960 17964 17966 17970 17972 17974 17975 17976 17978 17979 17980 17982 17984 17988 17990 17994 17996 18000 18006 18008 18014 18018 18020 18024 18030 18036 18038 18044 18048 18050 18056 18060 18066 18074 447348
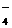 、ClO-、NO
、ClO-、NO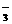 的氧化性会增强。如Fe2+、Na+、NO
的氧化性会增强。如Fe2+、Na+、NO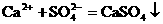
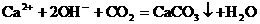
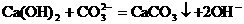
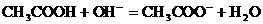 。
。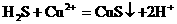 。
。 CaCl2+2NH3
CaCl2+2NH3 +2H2O
+2H2O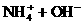
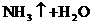
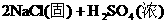
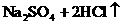
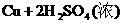
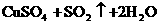
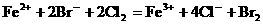 就错了。虽然反应前后各元素原子个数相等,但两边电荷数不等,因而是错误的。正确的写法是:
就错了。虽然反应前后各元素原子个数相等,但两边电荷数不等,因而是错误的。正确的写法是: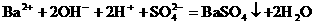
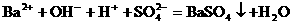 ,因为Ba(OH)2 电离时,电离出的
,因为Ba(OH)2 电离时,电离出的 与
与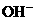 物质的量之比为1∶2而不是1∶1;H2SO4电离出的H+与SO
物质的量之比为1∶2而不是1∶1;H2SO4电离出的H+与SO 物质的量之比为2∶1而不是1∶1。
物质的量之比为2∶1而不是1∶1。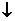 +2HClO
+2HClO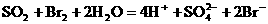
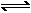 ”、“
”、“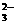 ,而HSO
,而HSO ;S2-与Cu2+、Pb2+等,不能大量共存。
;S2-与Cu2+、Pb2+等,不能大量共存。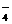 ;OH-与HCO
;OH-与HCO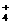 等不能大量共存。
等不能大量共存。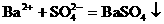 ,不仅表示BaCl2溶液与Na2SO4溶液之间的反应,还表示所有可溶性钡盐与可溶性硫酸盐溶液的反应。
,不仅表示BaCl2溶液与Na2SO4溶液之间的反应,还表示所有可溶性钡盐与可溶性硫酸盐溶液的反应。