网址:http://m.1010jiajiao.com/timu3_id_179776[举报]
I、(1)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
 限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
① 完成原电池的甲装置示意图(见右图),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
② 以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③ 甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
 (2)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在以上的材料中应选 作阳极。
(2)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在以上的材料中应选 作阳极。
II、电化学法制氢过程的示意图如右。反应池中反应物的流向采用气、液逆流方式,其目的是____________________;反应池中发生反应的化学方程式为________________。反应后的溶液进入电解池,电解总反应的离子方程式为____________________________________。
 III、通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
III、通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: .
查看习题详情和答案>>(1)利用炭粉可以将氮氧化物还原.
已知:N2(g)+O2(g)═2NO(g)△H=+180.6kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
反应:C(s)+2NO(g)═CO2(g)+N2(g)△H=
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如图甲所示,OH与NO2的反应为NO2+OH═HNO3.写出OH与NO反应的化学方程式:
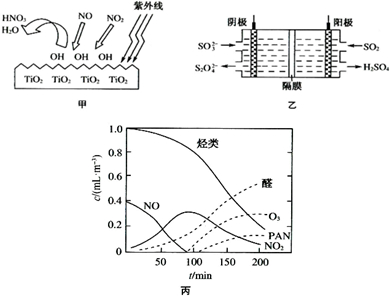
(3)图乙所示的装置能吸收和转化NO2、NO和SO2.
①阳极区的电极反应式为
②阴极排出的溶液中含S2
| O | 2- 4 |
| O | 2- 3 |
| O | 2- 4 |
| O | 2- 4 |
| O | 2- 3 |
③已知阴极生成的吸收液每吸收标准状况下7.84L的气体,阳极区新生成质量分数为49%的硫酸100g,则被吸收气体中NO2和NO的物质的量之比为
(4)O3、醛类、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟雾称为光化学烟雾.某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图丙所示.请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议:
硫酸亚铁蓉易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。
现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:
Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O (NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶审加入某种试剂除去油污,加热,充分反应后过滤、洗涤、干燥、称量,铁屑质量为![]() 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣于燥后称重,剩余铁屑质量为![]() 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,缓缓加热一段时间,将其冷却气结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为![]() 。
。
回答下列问题:
(1)能够甩于除去铁屑表面油污的试剂是 (填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)实验中三次用到过滤操作,完成该操作的玻璃仪器有 。
步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3·![]() H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论)。
。
查看习题详情和答案>>硫酸亚铁蓉易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。
现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:
Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O (NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶审加入某种试剂除去油污,加热,充分反应后过滤、洗涤、干燥、称量,铁屑质量为 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣于燥后称重,剩余铁屑质量为 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,缓缓加热一段时间,将其冷却气结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为 。
。
回答下列问题:
(1)能够甩于除去铁屑表面油污的试剂是 (填字母)。
| A.纯碱溶液 | B.烧碱溶液 | C.明矾溶液 | D.稀硫酸 |
步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3·
 H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论)。
。 查看习题详情和答案>>
步骤1:在盛有适量铁屑的锥形瓶中加入某种试剂除去油污,加热,充分反应后过滤、洗涤、干燥、称量,铁屑质量为m1;
步骤2:将处理过的铁屑加入到一定量的稀硫酸中,加热至50~80℃充分反应,趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为m2;
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,缓缓加热一段时间,将其冷却、结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为m3。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是_________(填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)实验中三次用到过滤操作,完成该操作的玻璃仪器有________________;步骤2中趁热过滤的目的是_____________________。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为________________________。
(4)铁屑表面常有少量的铁锈(Fe2O3·nH2O),对FeSO4的制备_______(填“有”或“无”)影响,理由是
_________________________ (用离子方程式回答)。
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为____________。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水___________________________ (简述实验操作、现象和结论)。