9.某同学在自主学习金属的知识时,设计以下实验报告,请将该实验报告补充完整。
[实验目的] 。
[实验用品]铁片、铜片、镁片、稀盐酸、硫酸铜溶液、硝酸银溶液
[实验内容]
|
实验步骤 |
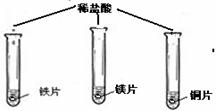 (在同温下,取大小相同、光亮的三种金属薄片,投入等体积、等浓度的足量稀盐酸中) (在同温下,取大小相同、光亮的三种金属薄片,投入等体积、等浓度的足量稀盐酸中) |
 |
|
实验现象 |
铁片和镁带表面都有气泡产生, 铜片表面却没有明显现象。 |
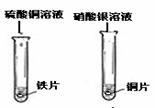
铁片表面有
,铜片表面有银白色固体析出。 |
|
分析 结论 |
铁与稀盐酸反应的化学方程式: , 活泼金属能与酸(稀盐酸)反应。 |
铁与硫酸铜溶液反应的化学方程式:
, 某些金属能与盐溶液发生反应 。 |
[实验思考]通过上述实验,能否证明Fe、Cu、Ag三种金属的活动性顺序?并说明理由:
。答案:探究金属的化学性质(或研究金属与酸和盐溶液反应)
Mg +2HCl →MgCl2+H2↑ 亮红色固体析出 Fe+ CuSO4 →Fe SO4+Cu
能。铁能与酸反应,铜不与酸反应,说明活动性铁>氢>铜;铜能置换出硝酸银溶液中的银,说明活动性铜>银,所以活动性铁>氢>铜>银。
(2010年上海市育鹰学校第7题)
7.某兴趣小组对Zn、Ni(镍)、Cu的金属活动性顺序展开了探究。
[提出假设]对三种金属的活动性顺序提出可能的假设①Zn>Ni>Cu;②Zn>Cu>Ni你觉得还有其他的可能性吗?请把它们写出来(一种即可)假设③ ……
[查阅资料]小红同学查阅了部分含镍化合物的溶解性如下表,且得知镍能与酸反应。
|
|
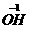 |
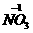 |
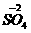 |
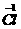 |
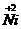 |
不 |
溶 |
溶 |
溶 |
[设计实验]同温下,取大小、厚度相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象。
[记录现象]请帮助小红把实验现象填写完整。
|
金属 |
Ni |
Zn |
Cu |
|
与盐酸反应的现象 |
气体产生缓慢 金属逐渐溶解 |
气体产生激烈 金属迅速溶解 |
|
[得出结论]原假设中正确的是 (填序号)。
写出镍与盐酸反应的化学方程式
[结论应用]
请选择另一类别的一种试剂设计实验,也同样达到一次验证上述假设的正确与否,写出你选择的试剂的化学式 。
答案:无
(2010年重庆市中考化学模拟试卷第22题)
 Na2SO4+Cu(OH)2
Na2SO4+Cu(OH)2 CuO +H2O或者 会变黑、变质
CuO +H2O或者 会变黑、变质  (1)写出右下图实验一中“更高”的化学方程式:
(1)写出右下图实验一中“更高”的化学方程式:
 (4分)某小组同学在协助老师整理化学试剂时,发现一瓶标签残缺的无色液体(如下图)(温馨提示:标签上的5%表示该混合物中主要成分所占的质量分数)。他们对此瓶无色液体是什么产生了兴趣,于是进行了如下探究。
(4分)某小组同学在协助老师整理化学试剂时,发现一瓶标签残缺的无色液体(如下图)(温馨提示:标签上的5%表示该混合物中主要成分所占的质量分数)。他们对此瓶无色液体是什么产生了兴趣,于是进行了如下探究。 [结论与解释](1)三
[结论与解释](1)三