0 124696 124704 124710 124714 124720 124722 124726 124732 124734 124740 124746 124750 124752 124756 124762 124764 124770 124774 124776 124780 124782 124786 124788 124790 124791 124792 124794 124795 124796 124798 124800 124804 124806 124810 124812 124816 124822 124824 124830 124834 124836 124840 124846 124852 124854 124860 124864 124866 124872 124876 124882 124890 447348
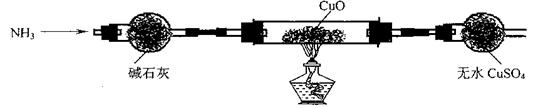 实验中观察到CuO变为红色物质,无水CuSO4变蓝色。同时生成一种无污染的气体。
实验中观察到CuO变为红色物质,无水CuSO4变蓝色。同时生成一种无污染的气体。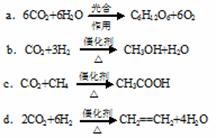 (2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如: CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol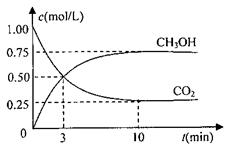 ①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
①从反应开始到平衡,氢气的平均反应速率v(H2)= 。 N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol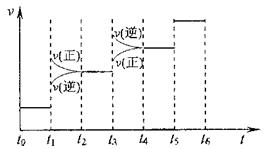 ①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。 其中表示平衡混合物中NH3含量最高的一段时间是
。
其中表示平衡混合物中NH3含量最高的一段时间是
。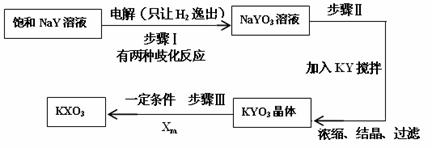 ⑷已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下:
⑷已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下: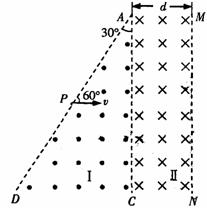 (22分)如图所示的空间分为I、Ⅱ两个区域,边界AD与边界AC的夹角为300,边界AC与MN平行,I、Ⅱ区域均存在磁感应强度大小为B的匀强磁场,磁场的方向分别为垂直纸面向外和垂直纸面向里,Ⅱ区域宽度为d,边界AD上的P点与A点间距离为2d.一质量为m、电荷量为+q的粒子以速度v=2Bqd/m,
(22分)如图所示的空间分为I、Ⅱ两个区域,边界AD与边界AC的夹角为300,边界AC与MN平行,I、Ⅱ区域均存在磁感应强度大小为B的匀强磁场,磁场的方向分别为垂直纸面向外和垂直纸面向里,Ⅱ区域宽度为d,边界AD上的P点与A点间距离为2d.一质量为m、电荷量为+q的粒子以速度v=2Bqd/m, (3)请在答卷上作出牵引力的功率随时间(P-t)的变化图线
(3)请在答卷上作出牵引力的功率随时间(P-t)的变化图线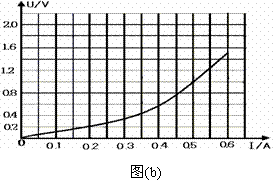
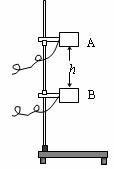 (6分)某同学利用光电门传感器设计了一个研究小物体自由下落时机械能是否守恒的实验,实验装置如图所示,图中A、B两位置分别固定了两个光电门传感器.实验时测得小物体上宽度为d的挡光片通过A的挡光时间为t1,通过B的挡光时间为t2.为了证明小物体通过A、B时的机械能相等,还需要进行一些实验测量和列式证明.
(6分)某同学利用光电门传感器设计了一个研究小物体自由下落时机械能是否守恒的实验,实验装置如图所示,图中A、B两位置分别固定了两个光电门传感器.实验时测得小物体上宽度为d的挡光片通过A的挡光时间为t1,通过B的挡光时间为t2.为了证明小物体通过A、B时的机械能相等,还需要进行一些实验测量和列式证明. (3)该同学设计可能会引起明显误差的地方是(请写出一种):
(3)该同学设计可能会引起明显误差的地方是(请写出一种): 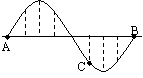 一列横波在t=0时的波形如图所示,C点此时向下运动,A、B两质点间距为8m,B、C两质点在平衡位置的间距为3m,当t=1s时,质点C恰好通过平衡位置,则该波的波速可能为
一列横波在t=0时的波形如图所示,C点此时向下运动,A、B两质点间距为8m,B、C两质点在平衡位置的间距为3m,当t=1s时,质点C恰好通过平衡位置,则该波的波速可能为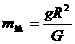 B.太阳的质量
B.太阳的质量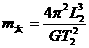

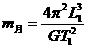 D.利用上面给出的M已知量可求月球、地球及太阳的密度
D.利用上面给出的M已知量可求月球、地球及太阳的密度