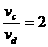25.(15分)
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验
 请填写下列空白:
请填写下列空白:
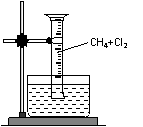
[实验一]用如图所示装置,收集一试管甲烷和氯气的混合气体,
光照后观察到量筒内形成一段水柱,认为有氯化氢生成。
(1)该反应的反应类型为 ;
(2)该反应的化学方程式为 ;
(只写第一步)
(3)水槽中盛放的液体应为 ;(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
[实验二]收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(4)该实验设计的错误之处 ;
[实验三]
步骤一:收集半试管氯气,加入10 mL 蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH = 3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL 蒸馏水,充分振荡,测得pH = 1.00。
(5)判断该反应中有氯化氢生成的依据是 ;
(6)假设氯气完全参与反应,且不考虑氯气溶解于水。往反应后的溶液中加水稀释到100.00 mL,分别取20.00 mL稀释液,以K2CrO4为指示剂,用浓度为0.01 mol·L-1的AgNO3溶液滴定溶液中的Cl-,滴定终点时消耗AgNO3溶液的体积平均为10.00 mL,则试管中原有氯气在标准状况下的体积为 mL;
步骤三:用5支试管充满甲烷和氯气的混合气体(各占50%),分别放在40 W的日光灯下光照不同时间后,加入10 mL 蒸馏水,充分振荡,测得pH如下表:
|
编号 |
1 |
2 |
3 |
4 |
5 |
|
光照时间 |
2 min |
4 min |
6 min |
8 min |
10 min |
|
反应后pH |
1.86 |
1.62 |
1.00 |
1.00 |
1.00 |
(7)该实验可得到结论: ;
步骤四:为探究不同光照条件对甲烷与氯气反应速率的影响。
(8)试设计一个可行的实验方案: 。
24.(15分)
高温裂解法处理工业废硫酸工艺流程图如下:
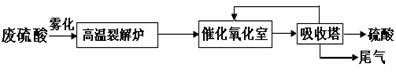
废硫酸高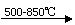 温裂解的基本原理可用下列方程按两个阶段进行
温裂解的基本原理可用下列方程按两个阶段进行
H2SO4(l) SO3(g)+ H2 O(g) △H= +176kJ·mol-1
2SO3(g) 2SO2(g)+ O2(g)
△H= +196k·mol-1
2SO2(g)+ O2(g)
△H= +196k·mol-1
为研究废硫酸的雾化和裂解情况,有关实验数据如下:
|
|
雾化后废硫酸液滴直径 |
废硫酸完全裂解所需时间 |
|
普通雾化器 |
800-1200 μm |
10 s以上 |
|
旋转式雾化器 |
600-850 μm |
8-10 s |
|
压缩风雾化器 |
400-650 μm |
6-7 s |
|
超声波雾化器 |
100-300 μm |
3.5-5 s |
(1)由上表数据可得出的结论是 ;
(2)废硫酸裂解成SO2总反应的热化学方程式为 ;
(3)在催化氧化室中发生反应:
2SO2(g)+ O2(g) 2SO3(g) △H= -196 kJ·mol-1
2SO3(g) △H= -196 kJ·mol-1
① 某温度时,该反应的平衡常数K=3.5,平衡后再充入一定量气体测得100 L的恒容密闭容器中含有3.0 mol SO2, 16.0 mol O2和3.0 mol SO3(g),此时平衡
移动;(填“向正反应方向”、“ 向逆反应方向”或“不”)
②上述反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是 ;(填字母)
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入3.0 mol N2
C.降低温度
D.在其他条件不变时,缩小容器的容积
 (4)尾气SO2用饱和Na2SO3溶液吸收可得到一种化工原料,反应的化学方程式为
;
(4)尾气SO2用饱和Na2SO3溶液吸收可得到一种化工原料,反应的化学方程式为
;
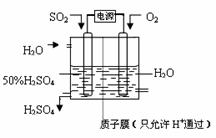
(5)科学家研究出以右图所示装置用电化
学原理生产硫酸的新工艺,其阳极的
电极反应式为 ,
总反应的化学方程式为 。
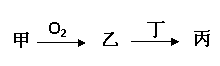 甲、乙、丙三种物质都含有A元素,只有甲是单质,其转化关系如下:
甲、乙、丙三种物质都含有A元素,只有甲是单质,其转化关系如下: 采用直线电机模式获得驱动力的列车可简化为如下情景:固定在列车下端的矩形金属框随车平移;轨道区域内存在垂直于金属框平面的磁场,磁感应强度沿Ox方向按正弦规律分布,最大值为B0,其空间变化周期为2d,整个磁场以速度v1沿Ox方向向前高速平移,由于列车沿Ox方向匀速行驶速度v2与磁场平移速度不同,而且v1>v2,列车相对磁场以v1-v2的速度向后移动切割磁感线,金属框中会产生感应电流,该电流受到的向前安培力即为列车向前行驶的驱动力。设金属框电阻为R,长PQ=L,宽NP=d,求:
采用直线电机模式获得驱动力的列车可简化为如下情景:固定在列车下端的矩形金属框随车平移;轨道区域内存在垂直于金属框平面的磁场,磁感应强度沿Ox方向按正弦规律分布,最大值为B0,其空间变化周期为2d,整个磁场以速度v1沿Ox方向向前高速平移,由于列车沿Ox方向匀速行驶速度v2与磁场平移速度不同,而且v1>v2,列车相对磁场以v1-v2的速度向后移动切割磁感线,金属框中会产生感应电流,该电流受到的向前安培力即为列车向前行驶的驱动力。设金属框电阻为R,长PQ=L,宽NP=d,求: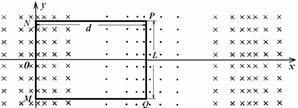 (1)如图为列车匀速行驶时的某一时刻,MN、PQ均处于磁感应强度最大值处,此时金属框内感应电流的大小和方向;
(1)如图为列车匀速行驶时的某一时刻,MN、PQ均处于磁感应强度最大值处,此时金属框内感应电流的大小和方向;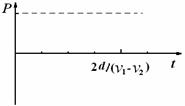 (3)列车匀速行驶时所获得的最大驱动力的大小,并定性画出驱动力功率随时间变化在
(3)列车匀速行驶时所获得的最大驱动力的大小,并定性画出驱动力功率随时间变化在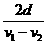 时间内的关系图线
时间内的关系图线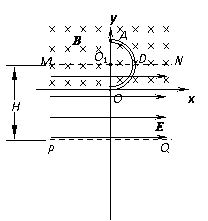 (19分)如图所示,在y≥0的区域内存在垂直于坐标平面向里的匀强磁场,磁感应强度大小为B;水平虚线MN、PQ区域内有水平向右电场强度的大小
(19分)如图所示,在y≥0的区域内存在垂直于坐标平面向里的匀强磁场,磁感应强度大小为B;水平虚线MN、PQ区域内有水平向右电场强度的大小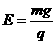 的匀强电场。半径为R的光滑绝缘空心半圆细管ADO固定在竖直平面内,圆心O1在MN上,直径AO垂直于MN。一质量为m、电荷量为q的带正电小球(可视为质点)从半圆管的A点由静止滑入管内,重力加速度为g。求:
的匀强电场。半径为R的光滑绝缘空心半圆细管ADO固定在竖直平面内,圆心O1在MN上,直径AO垂直于MN。一质量为m、电荷量为q的带正电小球(可视为质点)从半圆管的A点由静止滑入管内,重力加速度为g。求: ,电场力对带正电小球所做的功;
,电场力对带正电小球所做的功;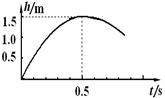 (15分)研究性学习小组在探究某球竖直向上运动过程中,通过位移传感器测得该球运动的高度与时间关系(从抛出时开始计时)如图所示。设运动过程所受的空气阻力大小保持不变,为简化计算g取10m/s2,求:
(15分)研究性学习小组在探究某球竖直向上运动过程中,通过位移传感器测得该球运动的高度与时间关系(从抛出时开始计时)如图所示。设运动过程所受的空气阻力大小保持不变,为简化计算g取10m/s2,求: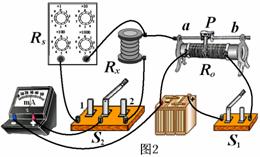 E.调节电阻箱RS的值,使电流表指针指在与上一次指针位置相同
E.调节电阻箱RS的值,使电流表指针指在与上一次指针位置相同
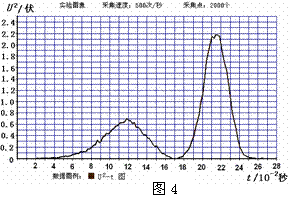 ②若螺线管线圈的电阻是90Ω,又从图4中U2-t图线与时间轴所围的面积约为103格,可以计算磁铁穿过螺线管过程中,在回路中产生的总电热是__________焦耳
②若螺线管线圈的电阻是90Ω,又从图4中U2-t图线与时间轴所围的面积约为103格,可以计算磁铁穿过螺线管过程中,在回路中产生的总电热是__________焦耳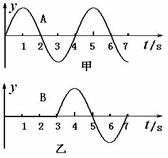 在X轴上有A、B两质点,其坐标分别是XA=0,XB=15m,有一简谐波沿X正方向传播,若以波传到A点开始计时,A,B的振动分别如图甲、乙所示。则10秒末,有关质点振动情况以下说法正确的是
在X轴上有A、B两质点,其坐标分别是XA=0,XB=15m,有一简谐波沿X正方向传播,若以波传到A点开始计时,A,B的振动分别如图甲、乙所示。则10秒末,有关质点振动情况以下说法正确的是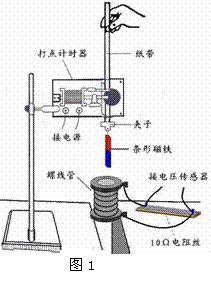 第Ⅱ卷必考部分共9题,157分。
第Ⅱ卷必考部分共9题,157分。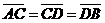 。将一正电荷从C点沿直线移到D点,则
。将一正电荷从C点沿直线移到D点,则 A.电势能始终增加
A.电势能始终增加 如图所示,将截面为正方形的真空腔abcd放置在一匀强磁场中,磁场方向垂直纸面向里.若有一束具有不同速率的电子由小孔a沿ab方向射入磁场,打在腔壁上的被吸收,则关于由小孔c和小孔d射出的电子的时间比值和运动速率比值正确的是
如图所示,将截面为正方形的真空腔abcd放置在一匀强磁场中,磁场方向垂直纸面向里.若有一束具有不同速率的电子由小孔a沿ab方向射入磁场,打在腔壁上的被吸收,则关于由小孔c和小孔d射出的电子的时间比值和运动速率比值正确的是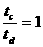 B.
B. 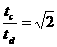 C.
C. 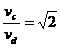 D.
D.