34.关于平抛运动研究的实验(每空2分,共20分)

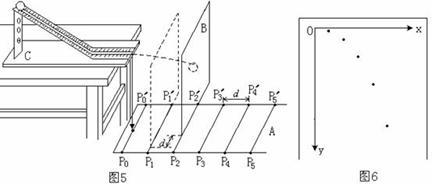 (1)下图为用频闪摄影方法拍摄的研究物体作平抛运动规律的照片.图中A、B、C为三个同时由同一点出发的小球,AA+为A球在光滑水平面上以速度v运动的轨迹;BB+为B球以速度v被水平抛出后的运动轨迹;CC+为C球自由下落的运动轨迹.通过分析上述三条轨迹可得出结论:做平抛运动的物体在水平方向做 运动;在竖直方向做
运动。
(1)下图为用频闪摄影方法拍摄的研究物体作平抛运动规律的照片.图中A、B、C为三个同时由同一点出发的小球,AA+为A球在光滑水平面上以速度v运动的轨迹;BB+为B球以速度v被水平抛出后的运动轨迹;CC+为C球自由下落的运动轨迹.通过分析上述三条轨迹可得出结论:做平抛运动的物体在水平方向做 运动;在竖直方向做
运动。
(2)某同学设计了一个研究平抛运动的实验。实验装置示意图如图5所示,A是一块平面木板,在其上等间隔地开凿出一组平行的插槽(图5中P0P0/ 、P1P1/ 、……),槽间距离均为d。把覆盖复写纸的白纸铺贴在硬板B上。实验时依次将B板插入A板的各插槽中,每次让小球从斜轨的同一位置由静止释放。每打完一点后,把B板插入后一槽中并同时向纸面内侧平移距离d。实验得到小球在白纸上打下的若干痕迹点,如图6所示。则实验前应对实验装置进行反复调节,直到斜槽末端切线_____、A板 、B板 。(选择“垂直”、“竖直”、或“水平”等进行填空)。实验过程中每次让小球从同一位置由静止释放,是为了使小球每次平抛时的初速度的大小和方向都______(选择“相同”或“不相同”填空);每次将B板向内侧平移距离d是为了使记录纸(图6所示)上每相邻两点之间的水平距离 (选“等于”、“大于”或“小于”进行填空)小球在水平方向上实际运动的距离。
|
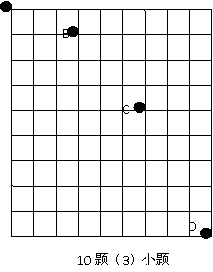 (3)、如图所示,方格坐标每边长5cm,某小球做平抛运动时分别经过A、B、C、D四点,重力加速度g取10m/s2,
(3)、如图所示,方格坐标每边长5cm,某小球做平抛运动时分别经过A、B、C、D四点,重力加速度g取10m/s2,
则在这四点中相邻两点间的时间 T = 秒,小球做平抛运动的初速度V0 = 米/秒,由题中的数据可以判断A点 (选择“就是”或“不是”填空)小球做平抛运动的抛出点。
33、(Ⅰ)(10分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是 (填写编号);与H2最容易化合的非金属单质是 (写物质名称)。
(2)写出元素③形成的具有较强氧化性的氢化物的电子式_____________________;
(3)写出上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 。
(4)写出④的最高价氧化物的水化物跟⑦的最高价氧化物的水化物反应的离子方程式____。
(Ⅱ)(6分)某金属重2.4 g,其原子核外有1.2 mol 电子,核内共有7.224×1023个中子,该金属与足量盐酸反应,有0.2 mol电子发生转移,生成了6.02×1022个阳离子。
(1)该金属元素符号是____________,摩尔质量是____________。
(2)原子核内有________个质子,________个中子。
(3)写出该金属与盐酸反应生成的氯化物的电子式 。
32.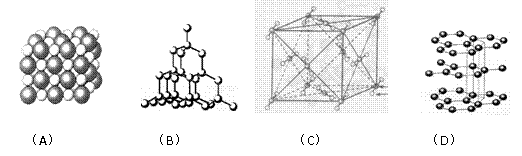 Ⅰ、(10分)如图表示一些晶体中的某些结构,它们分别是NaCl、干冰、金刚石、石墨结构中的某一种的某一部分。
Ⅰ、(10分)如图表示一些晶体中的某些结构,它们分别是NaCl、干冰、金刚石、石墨结构中的某一种的某一部分。
(1)其中代表金刚石的是(填编号字母,下同) ,金刚石属于 晶体。
(2)其中代表石墨的是 ,其晶体中碳原子呈平面 结构排列。
(3)其中代表NaCl的是 ,晶体中Na+与Cl-之间通过 键结合起来。
(4)代表干冰的是 ,它属于 晶体,CO2分子间通过 结合起来。
(5)上述物质中前三种熔点由高到低的排列顺序为 。
Ⅱ、(6分)下表是元素周期表的一部分,请回答有关问题:
|
主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
|
|
|
① |
② |
|
③ |
|
|
3 |
|
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
④ |
|
|
|
|
⑩ |
|
(1)表中化学性质最不活泼的元素,其元素符号为 。表中能形成两性氢氧化物的元素是 (用元素符号表示)
(2)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(3)③元素与⑩元素两者核电荷数之差是 。
(4)设计实验方案,比较⑦与⑩单质氧化性的强弱,写出有关反应的离子方程式
。
31.(14分) 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。
|
实验方案(I) |
实验现象(Ⅱ) |
答案(III) |
|
|
实验方案I |
实验现象II |
||
|
1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 加酚酞 |
A浮与水面,剧烈反应,放出气体, 熔成-个小球,在水面上无定向移 动,随之消失,溶液变红色。 |
1 |
|
|
2.向新制的H2S饱和溶 液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 |
2 |
|
|
3.钠与滴有酚酞的冷水反应 |
C.反应不十分剧烈,产生的气体 可以在空气中燃烧 |
3 |
|
|
4.镁带与2mol/L的盐酸 反应 |
D.剧烈反应,产生的气体可以在 空气中燃烧 |
4 |
|
|
5铝条与2mol/L的盐酸 反应 |
E.生成白色絮状沉淀,继而沉淀 消失 |
5 |
|
6.向AlCl3溶液中滴加 溶液至过量 溶液至过量 |
F.生成淡黄色沉淀 |
6 |
|
(2)通过以上实验分析了同周期元素的性质递变规律,从实验结果可以得出的结论是 。(3)写出实验步骤2、3和6的有关反应的离子方程式:
实验步骤2
实验步骤3
实验步骤6
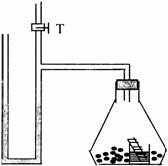 呼吸底物不是糖时,有氧呼吸消耗的O2和产生的CO2的体积并不相等,利用如图所示装置两套,设为甲、乙,测定单位质量小麦种子呼吸时CO2释放量与O2消耗量的比值,下列构思可以达到实验目的的是 ( )
呼吸底物不是糖时,有氧呼吸消耗的O2和产生的CO2的体积并不相等,利用如图所示装置两套,设为甲、乙,测定单位质量小麦种子呼吸时CO2释放量与O2消耗量的比值,下列构思可以达到实验目的的是 ( )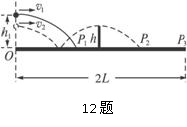 (2)若球在O点正上方以速度v2水平发出,恰好在最高点时越过球网落在球台的P2点(如图虚线所示),
(2)若球在O点正上方以速度v2水平发出,恰好在最高点时越过球网落在球台的P2点(如图虚线所示),