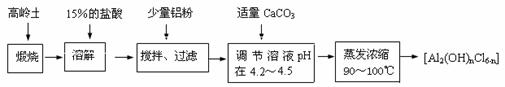
30.(17分)
钢铁腐蚀对生活生产危害极大,某研究小组为探究铁生锈的条件,将铁钉分别浸没在装有食盐水、蒸馏水、稀盐酸的试管中,一段时间后,你认为最快被腐蚀的是 ,实验过程中发现装有食盐水的试管底部出现了黑色粉末。对此黑色粉末的组成做了如下三种猜测:①FeO ②Fe3O4③二者混合物。请回答下列问题:
(1)铁钉生锈属于 腐蚀,其正极发生的电极反应式为
(2)Fe2+在溶液中很易被氧化,如用力震荡FeCl2溶液,会发现溶液很快由 色变为 色,
(3)请利用以下实验仪器和试剂完成对铁锈中铁的化合物的成份的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹、天平;3mol/L H2SO4、10mol/L H2SO4、3%H2O2、6mol/L HNO3、0.01mol/L KMnO4、NaOH稀溶液、0.1mol/L KI、20%KSCN、碱石灰、CO气体、蒸馏水。请在答题卡表格相关空格写出实验操作步骤、预期现象与结论。
|
实验步骤 |
实验操作 |
预期现象与结论 |
|
步骤1 |
|
|
|
步骤2 |
|
|
|
步骤3 |
|
(1)若
,猜测 成立(2)若
,猜测 或 成立。 |
|
步骤4 |
另取样品4.64g,用足量的CO还原,将生成的气体通入足量碱石灰中,碱石灰增重
g。 |
猜测②成立。 |
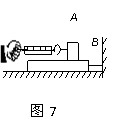
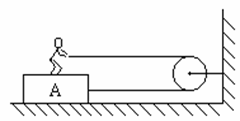 (16分)如图8,人重600牛,木块A重400牛,人与A、A与地面间的摩擦系数均为0.2,现人用水平力拉绳,使他与木块一起向右匀速直线运动,滑轮摩擦不计,求(1)人对绳的拉力.(2)人脚给A的摩擦力方向和大小。
(16分)如图8,人重600牛,木块A重400牛,人与A、A与地面间的摩擦系数均为0.2,现人用水平力拉绳,使他与木块一起向右匀速直线运动,滑轮摩擦不计,求(1)人对绳的拉力.(2)人脚给A的摩擦力方向和大小。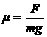 .
. (1)该同学为什么要把纸贴在木块上而不直接测量
(1)该同学为什么要把纸贴在木块上而不直接测量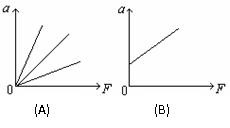 D、F2的方向是惟一的,但大小可有多个值
D、F2的方向是惟一的,但大小可有多个值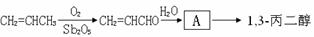
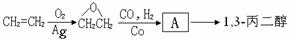
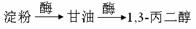
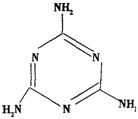
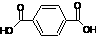 )为原料可以合成聚酯PTT,写出其化学方程式:
)为原料可以合成聚酯PTT,写出其化学方程式: 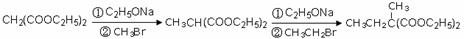
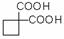 ,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②
,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②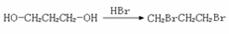 ,③合成反应流程图表示方法示例如下:
,③合成反应流程图表示方法示例如下: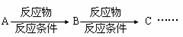 。
。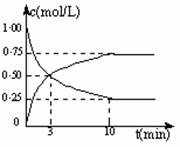 (1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应: CH3OH(g)+H2O(g) △H= - 49.0 kJ·mol-1。
CH3OH(g)+H2O(g) △H= - 49.0 kJ·mol-1。