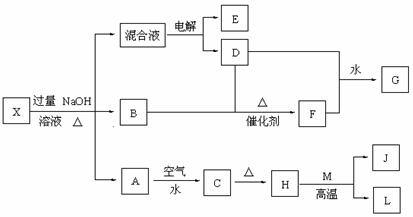
0 123623 123631 123637 123641 123647 123649 123653 123659 123661 123667 123673 123677 123679 123683 123689 123691 123697 123701 123703 123707 123709 123713 123715 123717 123718 123719 123721 123722 123723 123725 123727 123731 123733 123737 123739 123743 123749 123751 123757 123761 123763 123767 123773 123779 123781 123787 123791 123793 123799 123803 123809 123817 447348
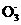 b.X
b.X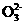 C.Y
C.Y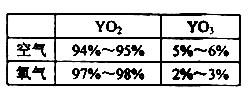 ②实验测得相同条件下一定量的Y单质分别
②实验测得相同条件下一定量的Y单质分别 。的KMnO4溶液24.00mL。该样品中Z的氧化物的质量分数是 。
。的KMnO4溶液24.00mL。该样品中Z的氧化物的质量分数是 。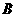 ,方向为垂直纸面向里,从磁场中同一位置
,方向为垂直纸面向里,从磁场中同一位置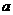 同一时刻射出两个粒子,一个是氘核
同一时刻射出两个粒子,一个是氘核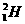 ,设初速为
,设初速为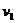 ;另一个是质子
;另一个是质子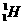 ,设初速为
,设初速为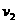 。
。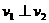 ,
,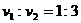 ,已知质子质量为
,已知质子质量为 、电荷量为
、电荷量为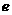 ,不计两个粒子的相互斥力,问两个粒子再次相遇所经历的时间最短是多
,不计两个粒子的相互斥力,问两个粒子再次相遇所经历的时间最短是多 少?
少? .(18分)如图所示,水平传送带AB足够长,质量为M=1kg的木块随传送带一起以v1=2m/s的速度向左匀速运动(传送带的速度恒定),
.(18分)如图所示,水平传送带AB足够长,质量为M=1kg的木块随传送带一起以v1=2m/s的速度向左匀速运动(传送带的速度恒定),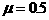 ,当木块运动到最左
,当木块运动到最左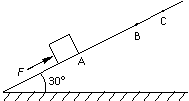 (16分)如图所示,小木块在沿斜面向上的恒定
(16分)如图所示,小木块在沿斜面向上的恒定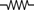 ):绕制螺线管金属丝的电阻率
):绕制螺线管金属丝的电阻率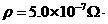 m,电阻
m,电阻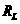 约为
约为
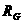 =500Ω
=500Ω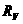 =4kΩ E、定值电阻R0:R0=50Ω
=4kΩ E、定值电阻R0:R0=50Ω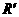 :全电阻约1k
:全电阻约1k G、电源E:电动势9V,内阻忽略不计
G、电源E:电动势9V,内阻忽略不计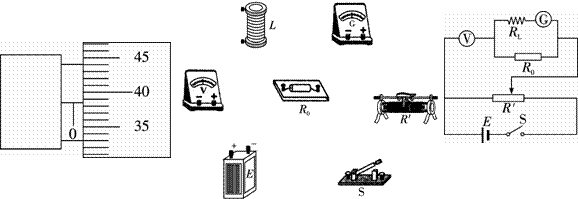 ②按图乙所示电路测量金属丝的电阻,请在图丙的实物图上连线。
②按图乙所示电路测量金属丝的电阻,请在图丙的实物图上连线。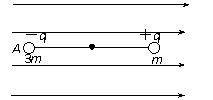 如图所示,一绝缘轻杆的两端各固定着一个小球,两小球带有等量异号的电荷,处于水平向右的匀强电场中,开始时,轻杆与电场方向平行.已知A、B两小球的质量分别为3m和m,且
如图所示,一绝缘轻杆的两端各固定着一个小球,两小球带有等量异号的电荷,处于水平向右的匀强电场中,开始时,轻杆与电场方向平行.已知A、B两小球的质量分别为3m和m,且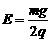 .现从静止开始释放小球,使轻杆绕其中心O转动,当轻杆转到竖直位置时,轻杆对A、B两小球在竖直方向的作用力的方向依次是(忽略A、B两小球之间的静电力)
.现从静止开始释放小球,使轻杆绕其中心O转动,当轻杆转到竖直位置时,轻杆对A、B两小球在竖直方向的作用力的方向依次是(忽略A、B两小球之间的静电力) A.木块静止,d1=
d2
A.木块静止,d1=
d2