31.I(8分)通过DNA重组技术培育成的动物称为转基因动物。运用这一技术可使羊奶中含有人体蛋白质,下图表示了这一技术的基本过程,在该工程中所用的基因“剪刀”能识别的序列平和切点是- -,请回答:
-,请回答:
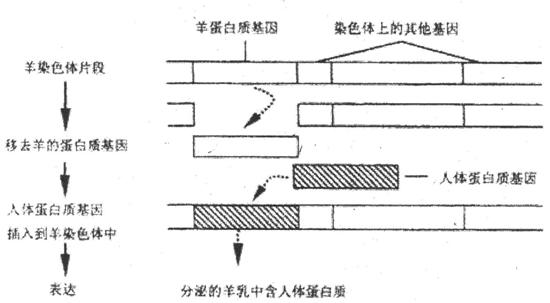
(1)从羊染色体中“剪下”羊蛋白质基因的酶是 。人体蛋白质基因“插入”后连接在羊体细胞染色体中时需要的酶是 。
(2)请画出运载体质粒被切割后形成黏性末端的过程图。
|
-  - - |
(3)与人肠杆菌细胞的基因相比,人体蛋白质基因编码区的主要特点是:
II(14分)人体细胞内含有抑制癌症发生的p53基因,生物技术可对此类基因的变化进行检测。
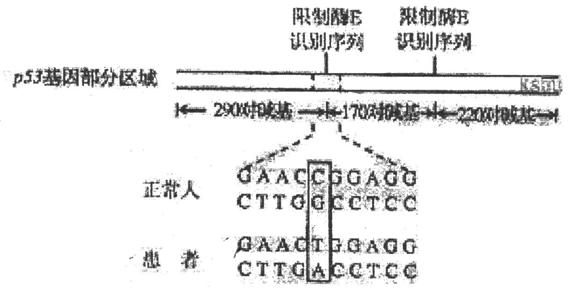
(1)人工合成目的基因的方法通常包括 和 。
(2)上图表示从正常人和患者体内获取的p53基因的部分区域。与正常人相比,患者在该区的碱基会发生改变,在上图中用方框圈出发生改变的碱基对(见上图);这种变异被称 为 。
(3)已知限制酶E识别序列为CCG,G,若用限制酶E分别完全切割正常人和患者的 p53基因部分区域(见上图),那么正常人的会被切成 个片段;而患者的则被切割成长度为 对碱基和 对碱基的两种片段。
(4)如果某人的p53基因部分区域经限制酶E完全切割后,共出现170、2.20、290和460碱基对的四种片段,那么该人的基因型是 (以A表示正常基因,a表示异常基因)。
 (14分)如图所示,向2 L容积不变的密闭容器中,加入24 g C,并使之均匀地平铺在容器底部,然后再加入18 g
H20,在一定温度一定温度下,发生如下可逆反应:
(14分)如图所示,向2 L容积不变的密闭容器中,加入24 g C,并使之均匀地平铺在容器底部,然后再加入18 g
H20,在一定温度一定温度下,发生如下可逆反应:
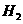 ,则用C0表示的反应速率为
。
,则用C0表示的反应速率为
。 键
键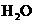
 取的取值范围是
。
取的取值范围是
。 
 离子的电子层结构与氖原子相同。
离子的电子层结构与氖原子相同。 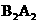 的结构式为 。
的结构式为 。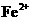 的还原性较强,可以被
的还原性较强,可以被 、
、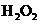 、
、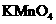 、
、 等很多氧化剂氧化,请配平下列氧化还原反应方程式:
等很多氧化剂氧化,请配平下列氧化还原反应方程式: 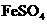 +
+  +
+
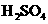 =
=
 +
+ 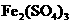 +
+  +
+ 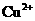 、
、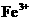 完全转化为氢氧化物沉淀,需溶液的pH分别为6.7、9.0、3.2。现有含
完全转化为氢氧化物沉淀,需溶液的pH分别为6.7、9.0、3.2。现有含 杂质的氯化铜晶体(
杂质的氯化铜晶体( ·
·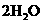 ),为制取纯净的
),为制取纯净的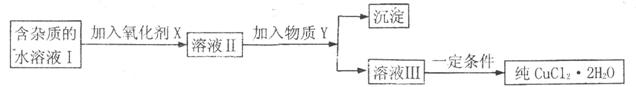
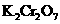 B.
B.

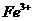 件的有关离子方程式是(物质Y在(2)中选择合适的选项)
件的有关离子方程式是(物质Y在(2)中选择合适的选项) (填“能”或“不能”)。如不能,
(填“能”或“不能”)。如不能,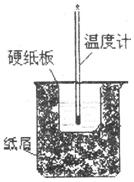 A.烧杯、玻璃棒没有洗涤
A.烧杯、玻璃棒没有洗涤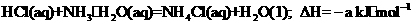
 b
b 个完全相同的小物块静止放在光滑水平面上沿一直线排开,相邻小物块间距离均为
个完全相同的小物块静止放在光滑水平面上沿一直线排开,相邻小物块间距离均为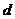 .现使物块l以初速度
.现使物块l以初速度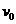 向物块2运动,碰撞后粘在一起,又向物块3运动,粘在一起后又向物块4运动……如此进行下去.
向物块2运动,碰撞后粘在一起,又向物块3运动,粘在一起后又向物块4运动……如此进行下去.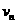 ;
;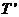 ,且
,且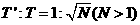 ,为了解释两者的不同,目前有一种流行的理论认为,在宇宙中可能存在一种望远镜观测不到的物质--暗物质,作为一种简化的模型,我们假定在以这两个星体连线为直径的球体内均匀分布着这种暗物质,而不考虑其他暗物质的影响,试根据这一模型和上述观测结果确定该星系间这种暗物质的密度。
,为了解释两者的不同,目前有一种流行的理论认为,在宇宙中可能存在一种望远镜观测不到的物质--暗物质,作为一种简化的模型,我们假定在以这两个星体连线为直径的球体内均匀分布着这种暗物质,而不考虑其他暗物质的影响,试根据这一模型和上述观测结果确定该星系间这种暗物质的密度。