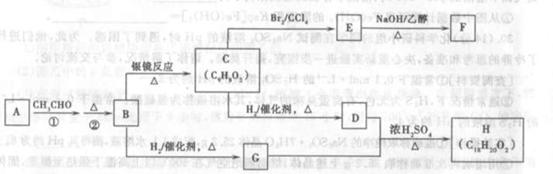
28.(13分)现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A元素原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,A、B、c三种元素都能与D元素形成两种或两种以上原子个数比不相同的常见化合物。E为常见金属元素,它与同主族下一周期元素的原子序数之差为18。试回答下列问题:
(1)均由A、C、D三种元素组成的不同类别的三种常见物质,当它们的水溶液浓度相同时,由水电离出的c(H+)由小到大的顺序为(填化学式): 。
(2)A与D可形成负一价双原子阴离子,请写出E的单质与过量该阴离子的水溶液反应的离
子方程式一。
(3)设反应①Fe(s)+BD2(g) FeD(s)+BD(g)
△H1其平衡常数为K1。
FeD(s)+BD(g)
△H1其平衡常数为K1。
反应2Fe(s)+A2D(g) FeD(s)+A2(g) △H2,其平衡常数为K2 。
FeD(s)+A2(g) △H2,其平衡常数为K2 。
在不同温度下,K1、K2的值如下:
|
温度 |
K1 |
K2 |
|
973K |
1.47 |
2.38 |
|
TK |
1.87 |
1.87 |
|
1173K |
2.15 |
1.67 |
I.从上表可以推断:△H2 0(填“>”或“<”)。
Ⅱ.现有反应③BD2(g)十A2(g)  BD(g)+A2D(g) △H3,其平衡常数为K3,则K2的值为
(用K1、K2表示)。若在TK时,将2mol的BD2(g)和1 moIlA2(g)放人1L密闭容器中,A2的最大转化率为
。
BD(g)+A2D(g) △H3,其平衡常数为K3,则K2的值为
(用K1、K2表示)。若在TK时,将2mol的BD2(g)和1 moIlA2(g)放人1L密闭容器中,A2的最大转化率为
。
(4)有人设想寻求合适的催化剂和电极材料,以A2、C2为电极反应物,以HCl一NH4Cl为电解质溶液制造新型燃料电池。试写出该电池的正极反应式 。
 (8分)[物理一物理3-4]
(8分)[物理一物理3-4]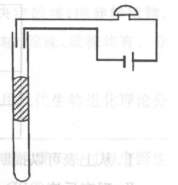 (8分)[物理一物理3-3]
(8分)[物理一物理3-3]

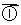 RCH2 -CH - CHCHO
RCH2 -CH - CHCHO RCH2CH===CCHO
RCH2CH===CCHO