摘要:4.利用化学反应测定的实验数据.如何进行物质的计算和推断? 例5. 某同学前往当地的石灰石矿区进行调查.他取回了若干块矿石样品.对样品中碳酸钙的质量分数进行检测.采用了的办法如下:取用8g这种石灰石样品.把40g稀盐酸分4次加入.测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水.不与盐酸反应).请计算: (1)8g石灰石样品中含有杂质多少克? (2)样品中碳酸钙的质量分数是多少? (3)下表中m的数值应该为多少? 序号 加入稀盐酸质量(g) 剩余固体质量(g) 第1次 10 5.5 第2次 10 m 第3次 10 1.2 第4次 10 1.2 (4)要得到280kgCaO.需要质量分数为80%的石灰石多少千克?(化学方程式:CaCO3 CaO+CO2↑) 解:(1)8g石灰石样品中含有杂质为1.2g. (2)样品中碳酸钙的质量分数=85% =3g (4)设需要80%的石灰石的质量为x CaCO3CaO+CO2↑ 100 56 X×80% 280kg x=625kg 分析:此题通过不断改变所加入的稀盐酸的质量.观察剩余固体的质量来判断稀盐酸何时不足.石灰石中CaCO3何时完全反应.由表中数据可知.在第三次加入10g盐酸后.固体剩余物质量不再减少.说明剩余的1.2g固体不和稀盐酸反应.应为杂质.然后.用8g石灰石样品质量-杂质质量=CaCO3质量.再除以样品质量.即可求出样品中碳酸钙的质量分数.第三小问也可从题意得出正解.即第一次加10g酸时固体的质量减少应和第二次一样.所以第二次剩余的固体质量就是3g.最后一问可利用含杂质问题的解题方法处理. 典型例题:
网址:http://m.1010jiajiao.com/timu3_id_97613[举报]
 实验室保存的-瓶浓盐酸:瓶和的标签的部分内容如图所示,请你根据标签上提供的数据回答下列问题.
实验室保存的-瓶浓盐酸:瓶和的标签的部分内容如图所示,请你根据标签上提供的数据回答下列问题.(1)用50mL浓盐酸可以配制溶质的质量分数为10%的盐酸
(2)利用刚配制好的HCI测定某二价金属的碳酸盐RC03的纯度,取样品16克(所含杂质不与酸反应,也不溶解于水),再取刚配好溶液7.3g混合至恰好反应后过滤,将溶液蒸干后得固体质量为11.1g
①该碳酸盐发生的化学方程式为
②利用已知条件求解反应生成C02质量(x)的比例式
③该碳酸盐化学式是
④向反应后所得溶液中加入32.4g水,则此时溶液中溶质的质量分数为
 实验室有一瓶质量分数较大的盐酸溶液,瓶上标签内容如图所示,请你根据标签上提供的数据与小禹同学一起解答下列问题:
实验室有一瓶质量分数较大的盐酸溶液,瓶上标签内容如图所示,请你根据标签上提供的数据与小禹同学一起解答下列问题:(1)用50mL盐酸可以配制溶质质量分数为14.6%的盐酸溶液的质量为
(2)小禹同学想利用刚配制好的盐酸溶液测定某碳酸盐(MCO3)样品的纯度:取20g该不纯的碳酸盐粉末(所含有的杂质不与酸反应.也不溶解于水),再取刚配制好的盐酸溶液50g混合,恰好完全反应.过滤,将滤液蒸干,得到粉末状固体质量为20.8g.
①盐酸与碳酸盐反应的化学方程式为
②利用已知条件求解反应生成二氧化碳质量(x)的比例式为
③该碳酸盐的纯度为
④若反应后的溶液只含一种溶质,向反应后所得溶液中加入38.7g水,则此时溶液中溶质的质量分数是
实验室有一瓶浓硫酸,瓶上标答内容如图所示,请你根据标签上提供的数据能答下列问题.
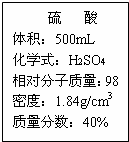 (1)用500mL浓硫酸可以配制溶质量分数为20%的硫酸 g;
(1)用500mL浓硫酸可以配制溶质量分数为20%的硫酸 g;
(2)利用刚配制好的硫酸测定某二价金属(M)的纯度,取6克该不纯金属粉未(所含有的杂质不与酸和水反应);再取刚配好的溶液98克,混合至恰好完全对应后过滤,将滤液蒸干.得到粉末状固体质量为24.0克.
①金属M发生反应的化学方程式为 ;
②利用已知条件求解反应生成氢气质量(X)的比例式为 ;
③金属M的元素符号是 ;
④该金属的纯度为 ;
⑤若反应后的溶液只含有一种溶质,向反应后所得溶液中加入141.6克水,则此时溶液中溶质的质量分数是 .
查看习题详情和答案>>
 (1)用500mL浓硫酸可以配制溶质量分数为20%的硫酸
(1)用500mL浓硫酸可以配制溶质量分数为20%的硫酸(2)利用刚配制好的硫酸测定某二价金属(M)的纯度,取6克该不纯金属粉未(所含有的杂质不与酸和水反应);再取刚配好的溶液98克,混合至恰好完全对应后过滤,将滤液蒸干.得到粉末状固体质量为24.0克.
①金属M发生反应的化学方程式为
②利用已知条件求解反应生成氢气质量(X)的比例式为
③金属M的元素符号是
④该金属的纯度为
⑤若反应后的溶液只含有一种溶质,向反应后所得溶液中加入141.6克水,则此时溶液中溶质的质量分数是
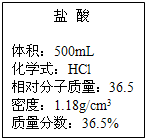 实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.
实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.(1)配制1OOg 7.3%的稀盐酸,需要该浓盐酸的质量是
(2)利用刚配制好的稀盐酸测定由两种金属组成的合金的成分.取20g该合金粉末于一只大烧杯,再加入刚配好的稀盐酸1OOg,
恰好完全反应后过滤(假设滤液无损失),将滤渣洗涤、干燥为13.5g,在空气中充分灼烧此滤渣,得到黑色固体粉末,将黑色粉末与足量的稀硫酸混合,粉末完全溶解,得到蓝色溶液.
①假设合金中能与盐酸反应的金属其元素符号为M(在化合物中该元素为+2价),则发生反应的化学方程式为
②利用已知条件求解反应生成氢气质量(x)的比例式为
③该合金的组成为
④若反应后的滤液中只有一种溶质,向反应后所得滤液中加入水29.7g,则此时溶液中溶质的质量分数是
 实验室保存的-瓶浓盐酸:瓶和的标签的部分内容如图所示,请你根据标签上提供的数据回答下列问题.
实验室保存的-瓶浓盐酸:瓶和的标签的部分内容如图所示,请你根据标签上提供的数据回答下列问题.