题目内容
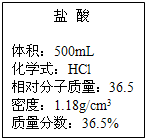 实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.
实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.(1)配制1OOg 7.3%的稀盐酸,需要该浓盐酸的质量是
(2)利用刚配制好的稀盐酸测定由两种金属组成的合金的成分.取20g该合金粉末于一只大烧杯,再加入刚配好的稀盐酸1OOg,
恰好完全反应后过滤(假设滤液无损失),将滤渣洗涤、干燥为13.5g,在空气中充分灼烧此滤渣,得到黑色固体粉末,将黑色粉末与足量的稀硫酸混合,粉末完全溶解,得到蓝色溶液.
①假设合金中能与盐酸反应的金属其元素符号为M(在化合物中该元素为+2价),则发生反应的化学方程式为
②利用已知条件求解反应生成氢气质量(x)的比例式为
③该合金的组成为
④若反应后的滤液中只有一种溶质,向反应后所得滤液中加入水29.7g,则此时溶液中溶质的质量分数是
分析:(1)根据溶液稀释时溶质质量不变计算;
(2)①根据金属能和酸反应生成盐和氢气的性质书写方程式;
②根据化学方程式的计算过程回答;
③根据信息“将滤渣洗涤、干燥为13.5g,在空气中充分灼烧此滤渣,得到黑色固体粉末,将黑色粉末与足量的稀硫酸混合,粉末完全溶解,得到蓝色溶液”推出滤渣中有铜,根据M的质量与盐酸中溶质的质量计算M的相对原子质量,再判断元素种类;
④根据根据化学方程式计算溶质的质量,根据质量守恒定律计算反应后溶液的质量,再根据溶液中溶质质量分数的计算公式计算出最后结果.
(2)①根据金属能和酸反应生成盐和氢气的性质书写方程式;
②根据化学方程式的计算过程回答;
③根据信息“将滤渣洗涤、干燥为13.5g,在空气中充分灼烧此滤渣,得到黑色固体粉末,将黑色粉末与足量的稀硫酸混合,粉末完全溶解,得到蓝色溶液”推出滤渣中有铜,根据M的质量与盐酸中溶质的质量计算M的相对原子质量,再判断元素种类;
④根据根据化学方程式计算溶质的质量,根据质量守恒定律计算反应后溶液的质量,再根据溶液中溶质质量分数的计算公式计算出最后结果.
解答:解:(1)解:设需要该浓盐酸的质量是为m,则m×36.5%=lOOg×7.3%,故m=20g;
(2)①金属与酸反应生成盐和水,在化合物中M元素为+2价,所以其氯化物的化学式为MCl2,所以方程式为:M+2HCl═MCl2+H2↑;
②解:设反应生成氢气质量为x
M+2HCl═MCl2+H2↑
73 2
lOOg×7.3% X
=7.3g
=
③根据信息“将滤渣洗涤、干燥为13.5g,在空气中充分灼烧此滤渣,得到黑色固体粉末,将黑色粉末与足量的稀硫酸混合,粉末完全溶解,得到蓝色溶液”推出滤渣中有铜.
设M的相对原子质量为R,20g-13.5g=6.5g
M+2HCl═MCl2+H2↑
R 73
6.5g 7.3g
=
R=65 所以M为锌
④解:设反应生成氯化锌的质量为Y,生成氢气的质量为Z
Zn+2HCl═ZnCl2+H2↑
73 136 2
7.3g Y Z
=
y=13.6g
=
z=0.2g
反应后的溶液质量为lOOg+6.5g-0.2g+29.7g=l36.0g,反应后溶液的溶质质量分数为
×100%=10%
答:反应后溶液的溶质质量分数为10%.
故答案为:(1)20g;
(2)①M+2HCl═MCl2+H2↑;②
=
;③Cu、Zn;④10%.
(2)①金属与酸反应生成盐和水,在化合物中M元素为+2价,所以其氯化物的化学式为MCl2,所以方程式为:M+2HCl═MCl2+H2↑;
②解:设反应生成氢气质量为x
M+2HCl═MCl2+H2↑
73 2
lOOg×7.3% X
=7.3g
| 73 |
| 2 |
| 7.3g |
| X |
③根据信息“将滤渣洗涤、干燥为13.5g,在空气中充分灼烧此滤渣,得到黑色固体粉末,将黑色粉末与足量的稀硫酸混合,粉末完全溶解,得到蓝色溶液”推出滤渣中有铜.
设M的相对原子质量为R,20g-13.5g=6.5g
M+2HCl═MCl2+H2↑
R 73
6.5g 7.3g
| R |
| 73 |
| 6.5g |
| 7.3g |
④解:设反应生成氯化锌的质量为Y,生成氢气的质量为Z
Zn+2HCl═ZnCl2+H2↑
73 136 2
7.3g Y Z
| 73 |
| 136 |
| 7.3g |
| y |
| 73 |
| 2 |
| 7.3g |
| z |
反应后的溶液质量为lOOg+6.5g-0.2g+29.7g=l36.0g,反应后溶液的溶质质量分数为
| 13.6g |
| 136.0g |
答:反应后溶液的溶质质量分数为10%.
故答案为:(1)20g;
(2)①M+2HCl═MCl2+H2↑;②
| 73 |
| 2 |
| 7.3g |
| x |
点评:化学计算是化学考查的热点之一,特别是关于化学式的计算、关于溶液的计算、关于化学方程式及方程式与溶液溶质质量分数相结合的计算,在考查中出现的频度最高.

练习册系列答案
相关题目
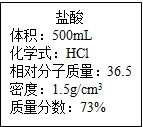 实验室有一瓶浓盐酸,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题:
实验室有一瓶浓盐酸,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题: 实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.
实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.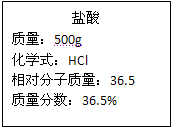 实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题:
实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题: 实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.
实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.