题目内容
实验室有一瓶浓硫酸,瓶上标答内容如图所示,请你根据标签上提供的数据能答下列问题.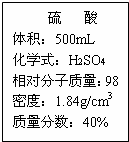 (1)用500mL浓硫酸可以配制溶质量分数为20%的硫酸
(1)用500mL浓硫酸可以配制溶质量分数为20%的硫酸(2)利用刚配制好的硫酸测定某二价金属(M)的纯度,取6克该不纯金属粉未(所含有的杂质不与酸和水反应);再取刚配好的溶液98克,混合至恰好完全对应后过滤,将滤液蒸干.得到粉末状固体质量为24.0克.
①金属M发生反应的化学方程式为
②利用已知条件求解反应生成氢气质量(X)的比例式为
③金属M的元素符号是
④该金属的纯度为
⑤若反应后的溶液只含有一种溶质,向反应后所得溶液中加入141.6克水,则此时溶液中溶质的质量分数是
分析:(1)利用稀释前后溶液中溶质质量不变,结合标签,根据浓硫酸的质量及质量分数计算稀释后溶液的质量;
(2)分析反应的反应过程,写出反应的化学方程式,根据反应物硫酸的质量,计算生成氢气的质量、反应消耗金属M的质量及金属的相对原子质量,并使用金属的相对原子质量确定金属元素;最后由生成硫酸盐的质量计算加水后所得溶液的质量分数.
(2)分析反应的反应过程,写出反应的化学方程式,根据反应物硫酸的质量,计算生成氢气的质量、反应消耗金属M的质量及金属的相对原子质量,并使用金属的相对原子质量确定金属元素;最后由生成硫酸盐的质量计算加水后所得溶液的质量分数.
解答:解:(1)设可以配制溶质量分数为20%的硫酸质量为x
500mL×1.84g/cm3×40%=x×20%
解之得 x=1840g
故答案为:1840g;
(2)①金属M呈+2价,所以与硫酸反应生成硫酸盐的化学式为MSO4;所以反应的化学方程式为M+H2SO4=MSO4+H2↑;
故答案为:M+H2SO4=MSO4+H2↑;
②根据反应的化学方程式,由硫酸的质量可求得生成氢气的质量;
M+H2SO4=MSO4+H2↑
98 2
98g×20% x
98:2=(98g×20%):x
解之得 x=0.4g
故答案为:98:2=(98g×20%):x
③硫酸中硫酸根的质量=98g×20%×
×100%=19.2g
则反应后所得粉末状固体盐中金属M的质量与硫酸根的质量比=(24.0g-19.2g):19.2g=24:96
则金属M的相对原子质量为24,可判断金属M为镁;
故答案为:Mg;
④该金属的纯度=
×100%=80%
故答案为:80%;
⑤溶液中溶质的质量分数=
×100%≈10%
500mL×1.84g/cm3×40%=x×20%
解之得 x=1840g
故答案为:1840g;
(2)①金属M呈+2价,所以与硫酸反应生成硫酸盐的化学式为MSO4;所以反应的化学方程式为M+H2SO4=MSO4+H2↑;
故答案为:M+H2SO4=MSO4+H2↑;
②根据反应的化学方程式,由硫酸的质量可求得生成氢气的质量;
M+H2SO4=MSO4+H2↑
98 2
98g×20% x
98:2=(98g×20%):x
解之得 x=0.4g
故答案为:98:2=(98g×20%):x
③硫酸中硫酸根的质量=98g×20%×
| 96 |
| 98 |
则反应后所得粉末状固体盐中金属M的质量与硫酸根的质量比=(24.0g-19.2g):19.2g=24:96
则金属M的相对原子质量为24,可判断金属M为镁;
故答案为:Mg;
④该金属的纯度=
| 24.0g-19.2g |
| 6g |
故答案为:80%;
⑤溶液中溶质的质量分数=
| 24.0g |
| (24.0g-19.2g)+98g-0.4g+141.6g |
点评:根据质量守恒定律,金属M与硫酸反应后所得溶液的质量=参加反应金属M的质量+稀硫酸的质量-放出氢气的质量.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 实验室有一瓶浓硫酸.瓶上标签内容如右图所示,请根据标签上提供的数据解答下列问题:
实验室有一瓶浓硫酸.瓶上标签内容如右图所示,请根据标签上提供的数据解答下列问题: 实验室有一瓶浓硫酸.瓶上标签内容如右图所示,请根据标签上提供的数据解答下列问题:
实验室有一瓶浓硫酸.瓶上标签内容如右图所示,请根据标签上提供的数据解答下列问题:
