摘要:2C2H5OH的总相对分子质量为 .等质量的SO2和SO3中氧元素的质量比为 ,要使SO2和SO3的含氧量相等.则SO2和SO3的质量比是
网址:http://m.1010jiajiao.com/timu3_id_91689[举报]
全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.下面是对铁的腐蚀条件及铁锈组成的探究.
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验.
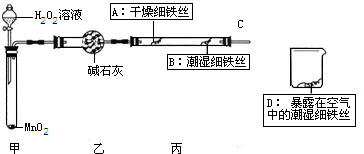
(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接人到装有水的烧杯中,微热甲装置,说明气密性良好的现象是 .
(2)反应开始后,甲装置中反应现象是 ,MnO2的作用 .
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与 和 有关.B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是 .
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3?H2O,还含有少量的FeCO3.某兴趣小组设计如图装置测定锈铁钉的组成.取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少.该过程中仅考虑发生:Fe2O3?H2O加热Fe2O3+H2O,FeCO3加热FeO+CO2↑,且不需要考虑装置中空气对本实验的影响.(碱石灰成分:CaO和NaOH固体混合物.物质的相对分子质量:Fe2O3?H2O 178,FeCO3116)
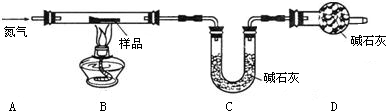
(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水 蒸气的总质量为 g,D装置中碱石灰的作用是 .
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为 、 .
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成.
①锈铁钉中Fe2O3?H2O的质量═ g.
②锈铁钉中FeCO3的质量═ g.
③锈铁钉中单质铁的质量分数═ .
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2? (填“有”或“无”),请通过计算说明.(假设铁在H2SO4和Fe2(SO4)3,混合溶液中先发生的反应为:
Fe+Fe2(SO4)3═3FeSO4,Fe2(SO4)3的相对分子质量为400)
[计算过程]. 查看习题详情和答案>>
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验.

(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接人到装有水的烧杯中,微热甲装置,说明气密性良好的现象是
(2)反应开始后,甲装置中反应现象是
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3?H2O,还含有少量的FeCO3.某兴趣小组设计如图装置测定锈铁钉的组成.取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少.该过程中仅考虑发生:Fe2O3?H2O加热Fe2O3+H2O,FeCO3加热FeO+CO2↑,且不需要考虑装置中空气对本实验的影响.(碱石灰成分:CaO和NaOH固体混合物.物质的相对分子质量:Fe2O3?H2O 178,FeCO3116)

(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水 蒸气的总质量为
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成.
①锈铁钉中Fe2O3?H2O的质量═
②锈铁钉中FeCO3的质量═
③锈铁钉中单质铁的质量分数═
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2?
Fe+Fe2(SO4)3═3FeSO4,Fe2(SO4)3的相对分子质量为400)
[计算过程]. 查看习题详情和答案>>
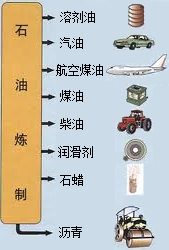 中国石油天然气集团公司近日宣布,在渤海湾滩海地区发现储量规模达十亿吨的大油田--冀东南堡油田.这对增强我国能源安全供应的保障能力具有重要意义.石油中主要含有碳和氢两种元素,利用石油中各成分的沸点不同,将它们分离(称为分馏),可得到不同的产品,使石油得到综合利用(如图).
中国石油天然气集团公司近日宣布,在渤海湾滩海地区发现储量规模达十亿吨的大油田--冀东南堡油田.这对增强我国能源安全供应的保障能力具有重要意义.石油中主要含有碳和氢两种元素,利用石油中各成分的沸点不同,将它们分离(称为分馏),可得到不同的产品,使石油得到综合利用(如图).(1)石油属于
(2)汽油是石油炼制的产品之一,直接作为燃料使用易造成环境污染.在汽油中加入适量乙醇,可节省石油资源,减少汽车尾气污染.写出乙醇在空气中燃烧的化学方程式:
(3)石油炼制的产品之一石蜡可用于制作蜡烛.
为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管口抽气.一段时间后熄灭蜡烛,再分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量.实验数据见下表.(相对原子质量:H-1 C-12 O-16)
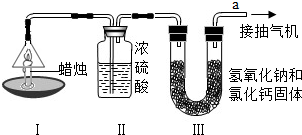
| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/g | 14.4 | 184.1 | 216.6 |
②由该实验数据计算,蜡烛中碳、氢元素的质量之比为
③装置Ⅱ和装置Ⅲ的顺序能否颠倒?
④理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是
⑤该实验能否准确测出蜡烛燃烧生成二氧化碳和水的质量?
 中国石油天然气集团公司近日宣布,在渤海湾滩海地区发现储量规模达十亿吨的大油田--冀东南堡油田.这对增强我国能源安全供应的保障能力具有重要意义.石油中主要含有碳和氢两种元素,利用石油中各成分的沸点不同,将它们分离(称为分馏),可得到不同的产品,使石油得到综合利用(如图).
中国石油天然气集团公司近日宣布,在渤海湾滩海地区发现储量规模达十亿吨的大油田--冀东南堡油田.这对增强我国能源安全供应的保障能力具有重要意义.石油中主要含有碳和氢两种元素,利用石油中各成分的沸点不同,将它们分离(称为分馏),可得到不同的产品,使石油得到综合利用(如图).(1)石油属于
混合
混合
物(选填混合、纯净);石油分馏发生了物理
物理
(选填物理、化学)变化;(2)汽油是石油炼制的产品之一,直接作为燃料使用易造成环境污染.在汽油中加入适量乙醇,可节省石油资源,减少汽车尾气污染.写出乙醇在空气中燃烧的化学方程式:
C2H5OH+3O2
2CO2+3H2O
| ||
C2H5OH+3O2
2CO2+3H2O
.
| ||
(3)石油炼制的产品之一石蜡可用于制作蜡烛.
为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管口抽气.一段时间后熄灭蜡烛,再分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量.实验数据见下表.(相对原子质量:H-1 C-12 O-16)

| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/g | 14.4 | 184.1 | 216.6 |
6:1
6:1
.②装置Ⅱ和装置Ⅲ的顺序能否颠倒?
不能
不能
(填“能”或“不能”).③理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是
与消耗的蜡烛比较,生成的二氧化碳和水中增加了参加反应的氧气所含氧元素
与消耗的蜡烛比较,生成的二氧化碳和水中增加了参加反应的氧气所含氧元素
.