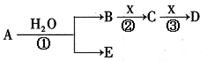
摘要:13.a.b.c.d.e是短周期元素.周期表中a与b.b与c相邻,a与e的最外层电子数之比为2∶3.b的最外层电子数比e的最外层电子数少1个,常见化合物d2c2与水反应生成c的单质.且溶液使酚酞试液变红. (1)e的元素符号是 . (2)a.b.c的氢化物稳定性顺序为 ,b的氢化物和b的最高价氧化物的水化物反应生成Z.则Z中的化学键类型为 .Z的晶体类型为 ,ab-离子的电子式为 . (3)由a.c.d形成化合物的水溶液显碱性.其原因是 . (4)一定量的d2c2与ac2反应后的固体物质.恰好与0.8 mol稀盐酸溶液完全反应.并收集到0.25 mol气体.则用物质的量表示该固体物质的组成为 . . [解析] 从常见化合物d2c2与水反应生成c的单质.且溶液使酚酞试液变红可推知d2c2为Na2O2.c为氧元素.a与b.b与c相邻.则a最外层电子数必大于或等于4.而a与e的最外层电子数之比为2∶3.a.e所在的主族只能为ⅣA 和ⅥA族.a与b.b与c相邻.则a.b.c三种元素的原子序数是连续的.依次推出b为氮元素.a为碳元素.e为硫元素.从上述推断中可推知a.b.c的氢化物稳定性顺序为CH4<NH3<H2O.b的氢化物和b的最高价氧化物的水化物反应的产物为NH4NO3.其中化学键为离子键和共价键.晶体类型为离子晶体.CN-离子的电子式为[∶C⋮⋮N∶]-.a.c.d形成的化合物为Na2CO3或Na2C2O4其水溶液呈碱性的原因为CO+H2OHCO+OH-或C2O+H2OHC2O+OH-.d2c2与ac2反应后的固体恰与0.8 mol稀盐酸反应收集到0.25 mol气体.假定d2c2与ac2即Na2O2与CO2反应后的产物完全为Na2CO3.恰好与0.8 mol稀盐酸反应.应生成0.4 mol CO2.实际生成0.25 mol.说明有Na2O2剩余.产生的气体有O2.该固体的组成应为Na2CO3和Na2O2.根据差量法推知有Na2O2 0.3 mol.Na2CO3 0.1 mol. [答案] CH4<NH3<H2O 共价键和离子键 离子晶体 [··C⋮⋮N··]- (3)CO+H2OHCO+OH-或C2O+H2OHC2O+OH- (4)0.3 mol Na2O2 0.1 mol Na2CO3
网址:http://m.1010jiajiao.com/timu3_id_89002[举报]
a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻,c和e同主族;a与c的最外层电子数之比为2:3,b的最外层电子数比c的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红.
(1)e的元素符号是
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)
 .
.
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8mol稀盐酸溶液完全反应,并收集到0.25mol气体,则用物质的量表示该固体物质的组成为
查看习题详情和答案>>
(1)e的元素符号是
S
S
.(2)a、b、c的氢化物稳定性顺序为(用分子式表示)
H2O>NH3>SiH4
H2O>NH3>SiH4
;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为离子键、共价键
离子键、共价键
,Z的晶体类型为离子晶体
离子晶体
;d2c2的电子式为

(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)
SiO32-+2H2O?H2SiO3+2OH-
SiO32-+2H2O?H2SiO3+2OH-
.(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8mol稀盐酸溶液完全反应,并收集到0.25mol气体,则用物质的量表示该固体物质的组成为
0.1molNa2CO3、0.3molNa2O2
0.1molNa2CO3、0.3molNa2O2
.A、B、C、D、E是短周期元素,周期表中A与B、B与C相邻,且C与E同主族;A与E的最外层电子数之比2:3,B的最外层电子数比C的最外层电子数少1个;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红.
(1)E的元素名称是
(2)A、B、C的氢化物稳定性由弱到强的顺序为(用分子式表示)
(3)写出D2C2的电子式
 .用电子式表示只含D、E两种元素的化合物的形成过程
.用电子式表示只含D、E两种元素的化合物的形成过程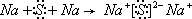
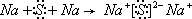
(4)写出D2C2与H2O反应的离子方程式
查看习题详情和答案>>
(1)E的元素名称是
硫
硫
.该元素在周期表中的位置为第三周期VIA族
第三周期VIA族
(2)A、B、C的氢化物稳定性由弱到强的顺序为(用分子式表示)
CH4<NH3<H2O
CH4<NH3<H2O
;B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中所含化学键的类型为离子键、极性键
离子键、极性键
(3)写出D2C2的电子式


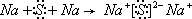
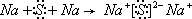
(4)写出D2C2与H2O反应的离子方程式
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.A、B、C、D、E是短周期元素,周期表中A、B、C同周期,C与E同主族.A与C的最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1,常见化合物D2C2与水反应生成C的单质,且溶液能使酚酞试液变红.
(1)元素E位于周期表中第
(2)D2C2的电子式为
 ;B的氢化物的结构式为
;B的氢化物的结构式为
 ;
;
(3)B的氢化物与B的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为
(4)B的最高价氧化物的水化物(浓溶液) 跟铜反应的离子方程式:
(5)化合物EC2通入到BaCl2和H2O2的混合溶液,生成白色沉淀,有关反应的离子方程式为
查看习题详情和答案>>
(1)元素E位于周期表中第
三
三
周期,ⅥA
ⅥA
族;(2)D2C2的电子式为




(3)B的氢化物与B的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为
离子键、共价键
离子键、共价键
.Z与D的最高价氧化物对应水化物浓溶液共热反应的离子方程式为:NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
.
| ||
(4)B的最高价氧化物的水化物(浓溶液) 跟铜反应的离子方程式:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
.(5)化合物EC2通入到BaCl2和H2O2的混合溶液,生成白色沉淀,有关反应的离子方程式为
SO2+H2O2=2H++SO42-,Ba2++SO42-=BaSO42-↓
SO2+H2O2=2H++SO42-,Ba2++SO42-=BaSO42-↓
.
29.a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2∶3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是 。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示) ;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为 ,Z的晶体类型为 ;ab-离子的电子式为 。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示) .
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为___________、___________。
查看习题详情和答案>>