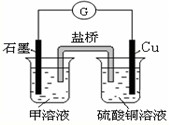
题目内容
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去)
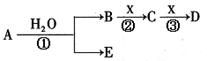
⑴若C为当今需要减排的一种热点温室气体,B为一种弱酸,则A化学式为______________。
⑵若D为白色胶状难溶物,且与A摩尔质量相等,则反应③的离子方程式为 ____________。
⑶若A为CO,则D的化学式为____________;t ℃时,在2 L的密闭的容器中加入3 mol CO和0.75 mol水蒸气,达到平衡时,CO的转化率为20%,在相同温度下再加入3.75 mol 水蒸气,再次达到平衡时,CO的转化率为_________。
【答案】(8分)
⑴ F2 (2分) ⑵3Al3++3AlO2-+6H2O=4Al(OH)3↓(2分) ⑶Na2CO3 (2分)60%(2分)
【解析】⑴若C为CO2,则符合转化关系“![]() 的A有三种:
的A有三种:![]() 、
、![]() 、
、![]() ,考虑到E为弱酸,则A应是F2。
,考虑到E为弱酸,则A应是F2。
⑵若D为白色胶状难溶物,设X为铝盐,D为Al(OH)3。先看转化关系:应有OH-![]() AlO2-
AlO2- ![]() Al(OH)3。再看相对分子质量:Mr(D) = 78,与Na2O2的摩尔质量相同,且转化关系也吻合,故反应③的离子方程式为3Al3++3AlO2-+6H2O=4Al(OH)3↓。
Al(OH)3。再看相对分子质量:Mr(D) = 78,与Na2O2的摩尔质量相同,且转化关系也吻合,故反应③的离子方程式为3Al3++3AlO2-+6H2O=4Al(OH)3↓。
⑶若“A为CO”,则B为CO2、X为NaOH,C为NaHCO3,D为Na2CO3。
根据CO的转化率为20%可求得在t ℃时该反应的平衡常数等于1,设再次达平衡时消耗xmolCO
CO+H2O![]() CO+H2
CO+H2
起始:3 4.5
变化:x x x x
平衡:3-x 4.5-x x x
则有:x2/[(3-x)(4.5-x)]=1,解得x=1.8mol,由此求得a (CO)=1.8/3×100%=60%。
【考点】元素及其化合物、化学反应速率与化学平衡

| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |
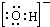
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热