摘要:31.(09宁夏卷37)[化学-选修化学与技术] 请回答氯碱的如下问题: (1)氯气.烧碱是电解食盐水时按照固定的比率k生成的产品.理论上k= ; (2)原料粗盐中常含有泥沙和Ca2+.Mg2+.Fe3+.SO42-等杂质.必须精制后才能供电解使用.精制时.粗盐溶于水过滤后.还要加入的试剂分别为①Na2CO3.②HCl③BaCl2.这3种试剂添加的合理顺序是 (3)氯碱工业是高耗能产业.一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中.相关物料的传输与转化关系如下图所示.其中的电极未标出.所用的离子膜都只允许阳离子通过. ①图中X.Y分别是 . .分析比较图示中氢氧化钠质量分数a%与b%的大小 ; ②分别写出燃料电池B中正极.负极上发生的电极反应正极: ;负极: ; ③这样设计的主要节(电)能之处在于 . . 答案: (1)k=M(Cl2)/2M=71/80=1:1.13或0.89 (2)③①② (3)①Cl2H2a%小于b%②O2+4e-+2H2O=4OH- H2-2e-+2OH-=2H2O③燃料电池可以补充电解池消耗的电能,提高产出碱液的浓度,降低能耗 解析: (1)只要了解电解饱和食盐水的化学方程式2NaCl+2H2O2NaOH+H2↑+Cl2↑即可得到.k=M(Cl2)/2M=71/80=1:1.13或0.89, (2)只要抓住除钡离子要放在除碳酸根离子前即可得到顺序关系:③①②, (3)本题突破口在于B燃料电池这边.通空气一边为正极.那么左边必然通H2.这样Y即为H2,再转到左边依据电解饱和食盐水的化学方程式可知唯一未知的就是X.必然为Cl2了,A中的NaOH进入燃料电池正极再出来.依据O2+4e-+2H2O=4OH-可知NaOH+浓度增大.
网址:http://m.1010jiajiao.com/timu3_id_88744[举报]
【化学--选修化学与技术】
(1)纯碱是一种重要的化工原料.目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺.
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:
②写出“联合制碱法”有关反应的化学方程式:
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
(2)钢铁工业对促进经济和社会发展起了重要作用.
①炼钢时,加入硅、锰和铝的目的是
②不锈钢含有的Cr元素是在炼钢过程的氧吹
③炼铁和炼钢生产中,尾气均含有的主要污染物是
查看习题详情和答案>>
(1)纯碱是一种重要的化工原料.目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺.
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:
2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
; 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O②写出“联合制碱法”有关反应的化学方程式:
NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2ONH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
;2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
“氨碱法”CO2来源于石灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气
“氨碱法”CO2来源于石灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气
;(2)钢铁工业对促进经济和社会发展起了重要作用.
①炼钢时,加入硅、锰和铝的目的是
脱氧和调整钢的成分
脱氧和调整钢的成分
.②不锈钢含有的Cr元素是在炼钢过程的氧吹
后
后
(填“前”或“后”)加入,原因是避免Cr被氧化
避免Cr被氧化
.③炼铁和炼钢生产中,尾气均含有的主要污染物是
CO
CO
.从环保和经济角度考虑,上述尾气经处理可用作燃料
燃料
.
【化学--选修化学与技术】
下图是某工厂对海水资源进行综合利用的示意图.
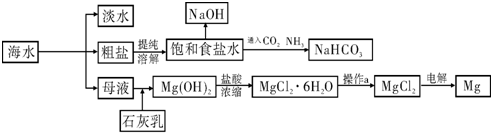
请回答下列问题:
(1)请列举一种海水淡化的方法 .;
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是 ,NaOH在电解槽的 室生成,由饱和食盐水制取NaOH的化学方程式为 ;
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是 .再由NaHCO3制得纯碱,化学方程式为 .
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
结合表中数据和实际生产情况说明,工业上生产镁采用电解MgCl2而不是电解MgO的理由 .
查看习题详情和答案>>
下图是某工厂对海水资源进行综合利用的示意图.

请回答下列问题:
(1)请列举一种海水淡化的方法
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
(化学--选修化学与技术)
海水中溶解了大量的气体物质和各种盐类.人类在陆地上发现的100多种元素,在海水中可以找到80多种.海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景.回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大.为克服蒸馏法海水淡化的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议
(2)使用离子交换树脂与水中的离子进行交换也是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式
(3)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
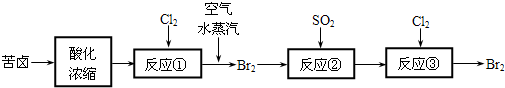
①反应②的离子方程式为
(4)苦卤中含有NaCl、MgCl2、KCl、MgSO4.用简要的文字说明如何测定苦卤中MgCl2的含量
查看习题详情和答案>>
海水中溶解了大量的气体物质和各种盐类.人类在陆地上发现的100多种元素,在海水中可以找到80多种.海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景.回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大.为克服蒸馏法海水淡化的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议
充分利用潮汐能、风能、太阳能等海边富有的洁净能源
充分利用潮汐能、风能、太阳能等海边富有的洁净能源
.(2)使用离子交换树脂与水中的离子进行交换也是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式
CH2=CHCOONa
CH2=CHCOONa
.(3)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):

①反应②的离子方程式为
SO2+Br2+2H2O=4H++2Br-+SO42-
SO2+Br2+2H2O=4H++2Br-+SO42-
; ②从反应③后的四氯化碳溶液中分离出单质溴的方法是蒸馏
蒸馏
.(4)苦卤中含有NaCl、MgCl2、KCl、MgSO4.用简要的文字说明如何测定苦卤中MgCl2的含量
先用足量BaCl2溶液沉淀硫酸根离子,求出硫酸根离子的总量,并求出MgSO4的量,然后用足量NaOH溶液沉淀Mg2+,求出总的Mg2+,减去MgSO4中的Mg2+得到MgCl2的量
先用足量BaCl2溶液沉淀硫酸根离子,求出硫酸根离子的总量,并求出MgSO4的量,然后用足量NaOH溶液沉淀Mg2+,求出总的Mg2+,减去MgSO4中的Mg2+得到MgCl2的量
.【化学--选修化学与技术】
在工厂中常使用煤作燃料,但煤燃烧后会产生有害的SO2,按“循环经济”的模式,就是要将SO2收集起来,把它变为有用的东西.
(1)向大气中过量排放SO2将会形成酸雨污染.正常雨水的pH约为
(2)三氧化硫通入浓氨水,可得到一种肥料,写出反应的化学的方程式:
(3)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为
(4)近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法:
第一步是用Na2SO3水溶液吸收SO2;
第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2水蒸气副产品,写出上述两步反应的化学方程式:
①
②
查看习题详情和答案>>
在工厂中常使用煤作燃料,但煤燃烧后会产生有害的SO2,按“循环经济”的模式,就是要将SO2收集起来,把它变为有用的东西.
(1)向大气中过量排放SO2将会形成酸雨污染.正常雨水的pH约为
5.6
5.6
.(2)三氧化硫通入浓氨水,可得到一种肥料,写出反应的化学的方程式:
SO3+2NH3?H2O=(NH4)2SO4+H2O
SO3+2NH3?H2O=(NH4)2SO4+H2O
(3)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为
SO2+Br2+2H2O=2H2SO4+2HBr
SO2+Br2+2H2O=2H2SO4+2HBr
.反应后溶液的pH变小
变小
(填“变大”、“变小”或“不变”).若每次取样的空气为200mL,通入足量的溴水中,测得平均有2.408×1018个电子转移,则SO2的含量为0.64
0.64
mg?L-1,若规定空气中SO2含量不得超过0.02mg?L-1,则样气是否符合大气的质量标准不符合
不符合
(填“符合”或“不符合”).(4)近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法:
第一步是用Na2SO3水溶液吸收SO2;
第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2水蒸气副产品,写出上述两步反应的化学方程式:
①
Na2SO3+SO2+H2O=2NaHSO3
Na2SO3+SO2+H2O=2NaHSO3
.②
2NaHSO3
Na2SO3+SO2↑+H2O
| ||
2NaHSO3
Na2SO3+SO2↑+H2O
.
| ||
【化学-选修 化学与技术】
工业上用硫铁矿为主要原料抽取硫酸,主要设备有沸腾米,接触室和吸引塔.
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是 .
(2)为了充分利用反应放出的热量,接触室中应安装 (填设备名称);吸引塔中填充许多瓷管,其作用是 .
(3)吸收塔排放的尾气中含有少量的SO2,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用.
传统的方法是:尾气中的SO2通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式: ,其优点是 .
创新方法是:将尾气中的SO2用Na2SO3溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式: ,创新方法与传统方法相比,其优点是 .
(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是 (填序号)
A.从沸腾炉出来的炉气需净化,因为炉气中的SO2与杂质反应
B.硫酸生产中常采用高压条件,目的是提高SO2的转化率
C.SO2被氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.SO3用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO3吸收完全
(5)某硫酸厂若要生产8吨98%的浓硫酸至少需要标准状况下的空气 m3( O2空气中的体积分数按20%计算).
查看习题详情和答案>>
工业上用硫铁矿为主要原料抽取硫酸,主要设备有沸腾米,接触室和吸引塔.
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是
(2)为了充分利用反应放出的热量,接触室中应安装
(3)吸收塔排放的尾气中含有少量的SO2,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用.
传统的方法是:尾气中的SO2通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:
创新方法是:将尾气中的SO2用Na2SO3溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:
(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是
A.从沸腾炉出来的炉气需净化,因为炉气中的SO2与杂质反应
B.硫酸生产中常采用高压条件,目的是提高SO2的转化率
C.SO2被氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.SO3用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO3吸收完全
(5)某硫酸厂若要生产8吨98%的浓硫酸至少需要标准状况下的空气