摘要:2.用0.1 mol•.的盐酸滴定0.10 mol•.的氨水.滴定过程中不可能出现的结果是 A.>, > B. =, = C. >, > D. >,> 答案:C 解析: 溶液中不可能出现阴离子均大于阳离子的情况.不遵循电荷守恒.故C项错.
网址:http://m.1010jiajiao.com/timu3_id_88622[举报]
下列图象表达正确的是( )
A、 如图表示25℃时,用0.1 mol?L-1的盐酸滴定20 mL 0.1 mol?L-1的NaOH溶液 | B、 如图表示常温下,两份足量、等浓度的盐酸与等量锌粉反应时,其中一份滴加了少量硫酸铜溶液 | C、 如图表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 | D、 如图表示适当升高稀硫酸的温度 |
下列图示与对应的叙述相符的是( )
A、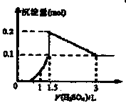 图表示向1L浓度均为0.1 mol?L-1的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol?L-1稀H2SO4溶液,产生沉淀量的变化 | B、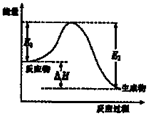 图中逆反应的热效应△H=E1-E2<0,所以逆反应为放热反应 | C、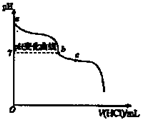 图表示向20mL 0.1mol?L-1 Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液,溶液pH的变化,c点溶液中:c(HCO3-)+2c(CO32-)+c(Cl-)>c(Na+) | D、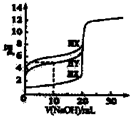 用0.1 mol?L-1NaOH溶液分别滴定浓度相同的三种一元酸,由图中曲线可确定HX的酸性最强 |

 (2012?浙江模拟)下列说法正确的是( )
(2012?浙江模拟)下列说法正确的是( )