题目内容
下列图象表达正确的是( )
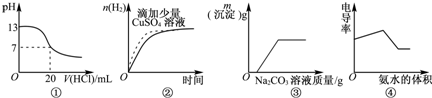
A、 如图表示25℃时,用0.1 mol?L-1的盐酸滴定20 mL 0.1 mol?L-1的NaOH溶液 | B、 如图表示常温下,两份足量、等浓度的盐酸与等量锌粉反应时,其中一份滴加了少量硫酸铜溶液 | C、 如图表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 | D、 如图表示适当升高稀硫酸的温度 |
分析:A、根据NaOH在滴定开始时的pH、以及滴定终点发生突跃来判断;
B、根据原电池可加快化学反应速率,氢气的质量由锌粉的质量决定;
C、根据向CaCl2与盐酸的混合溶液中慢慢滴入Na2CO3溶液,Na2CO3首先与HCl反应放出气体二氧化碳,待完全反应后,继续与CaCl2反应生成碳酸钙沉淀;
D、根据硫酸为强电解质,在溶液中已经完全电离分析.
B、根据原电池可加快化学反应速率,氢气的质量由锌粉的质量决定;
C、根据向CaCl2与盐酸的混合溶液中慢慢滴入Na2CO3溶液,Na2CO3首先与HCl反应放出气体二氧化碳,待完全反应后,继续与CaCl2反应生成碳酸钙沉淀;
D、根据硫酸为强电解质,在溶液中已经完全电离分析.
解答:解:A、0.1mol?L-1NaOH溶液的pH为13,用0.1mol?L-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错误;
B、锌粉与硫酸铜反应生成了铜,消耗了锌粉,锌粉、铜和盐酸构成了原电池,加快了化学反应速率,但产生的氢气减少,故B错误;
C、向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液,开始加入Na2CO3时先和盐酸反应,没有沉淀生成,图象符合,故C正确;
D、硫酸属于强电解质,在溶液中已经完全电离出硫酸根离子和氢离子,升高温度,溶液中的氢离子浓度不变,溶液的pH不变,故D错误;
故选C.
B、锌粉与硫酸铜反应生成了铜,消耗了锌粉,锌粉、铜和盐酸构成了原电池,加快了化学反应速率,但产生的氢气减少,故B错误;
C、向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液,开始加入Na2CO3时先和盐酸反应,没有沉淀生成,图象符合,故C正确;
D、硫酸属于强电解质,在溶液中已经完全电离出硫酸根离子和氢离子,升高温度,溶液中的氢离子浓度不变,溶液的pH不变,故D错误;
故选C.
点评:本题以图象与中和滴定、化学反应的先后顺序、原电池对化学反应速率的影响来考查学生,这些知识点是新课程改革考查的重点,明确考点“形变神不变”,做到善于抓规律即可,本题难度中等.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
下列图象表达正确的是( )


| A、图①表示25℃时,用0.1mol?L-1盐酸滴定20mL 0.1mol?L-1氨水 | B、图②表示常温下,等量锌粉分别与两份足量的等体积等浓度的盐酸反应 | C、图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 | D、图④表示向醋酸溶液中滴入氨水 |
下列图象表达正确的是( )
A、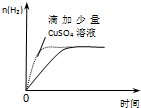 等质量锌粉与足量盐酸反应 | B、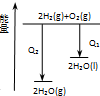 氢气与氧气反应中的能量变化 | C、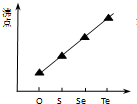 气态氢化物沸点 | D、 催化反应与非催化反应过程中的能量关系 |