摘要:13.现有A.B.C.D.E.F六种常见化合物.已知它们:阳离子分别有K+.Ag+.Na+.Ba2+.Fe2+.Al3+,阴离子分别有Cl-.OH-.AlO.NO.SO.CO.将它们分别配成0.1 mol/L的溶液进行如下实验: ①测得溶液A.C.E均呈碱性.且碱性:A>E>C.E的焰色呈浅紫色, ②向B溶液中滴加稀氨水至过量.先生成沉淀.后沉淀全部溶解, ③向F溶液中滴加稀硝酸.溶液变成棕黄色.且有无色气体生成, ④向D溶液中滴加Ba(NO3)2溶液无明显现象. (1)写出A.D.E.F的化学式: A , D , E , F . (2)用离子方程式解释C溶液的碱性: . (3)写出实验③中反应的离子方程式: . 解析:溶液呈碱性的阴离子为OH-.CO.AlO,根据实验②可以确定B为AgNO3.根据实验③可以确定F可能为FeCl2或者FeSO4.根据实验④可以确定D不可能含有SO.所以F为FeSO4.D为AlCl3.由于氢氧化铝的酸性小于碳酸氢根.故偏铝酸盐的碱性强于碳酸盐.结合碱性:A>E>C.可以确定A为Ba(OH)2.E为KAlO2.C为Na2CO3.C溶液呈碱性的原因:CO+H2OHCO+OH-.实验③中反应的离子方程式:3Fe2++NO+4H+===3Fe3++NO↑+2H2O. 答案:2 AlCl3 KAlO2 FeSO4 (2)CO+H2OHCO+OH- (3)3Fe2++NO+4H+===3Fe3++NO↑+2H2O
网址:http://m.1010jiajiao.com/timu3_id_85311[举报]
现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构.已知:
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G
P
Q
M+P
④E和D是同主族元素,氢化物(H2E)常温下为气态.
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)C元素在周期表的位置
 .
.
(2)A元素的原子结构示意图是
 .化合物X所含化学键类型有
.化合物X所含化学键类型有
(3)G气体的检验方法为
(4)E的非金属性比F
查看习题详情和答案>>
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G
| D的单质 |
| D的单质 |
| H2O |
④E和D是同主族元素,氢化物(H2E)常温下为气态.
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)C元素在周期表的位置
N元素处于第二周期、ⅤA族
N元素处于第二周期、ⅤA族
;B2E的电子式为

(2)A元素的原子结构示意图是


离子键和共价键
离子键和共价键
.(3)G气体的检验方法为
将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则该气体为NH3(其他合理答案也可)
将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则该气体为NH3(其他合理答案也可)
.(4)E的非金属性比F
弱
弱
(填“强”或“弱”),并用化学事实加以说明(用化学方程式表示)H2S+Cl2=S+2HCl(其他合理答案也可)
H2S+Cl2=S+2HCl(其他合理答案也可)
. (1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.①写出元素符号:A
H
H
,CS
S
,EK
K
.②B、D的最高价氧化物对应水化物相互反应的离子方程式为:
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.③用电子式表示C与E形成E2C的过程:


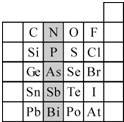
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
①阴影部分元素N在元素周期表中的位置为第
二
二
周期第ⅤA
ⅤA
族.根据元素周期律,预测:酸性强弱 H3AsO4
<
<
H3PO4.(用“>”或“<”表示)②元素S的最高正价和最低负价的代数和为
+4
+4
,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度更小
更小
.(选填“更大”、“更小”或“相同”)③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
Br-、SO42-、H+
Br-、SO42-、H+
.④下列说法正确的是
A、B、D
A、B、D
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱.
 [化学-选修物质结构与性质]现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元(图形以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相同的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
[化学-选修物质结构与性质]现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元(图形以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相同的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式①
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序
(3)F分子的空间构型是①
(4)C分子的中心原子杂化类型是
现有A,B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气态分子.
试回答下列问题:
(1)E、F的气态氢化物的稳定性为
(2)E与F可形成E2F2的化合物,其化学式为
(3)C、D形成的一种化合物能与D、E形成的化合物在溶液中发生氧化还原反应,其离子方程式为
(4)A、C、E三种元素形成的一种常见化合物H,其浓溶液在加热条件下可与ag铜反应,则被还原的H的物质的量为
mol
mol.
查看习题详情和答案>>
试回答下列问题:
(1)E、F的气态氢化物的稳定性为
HCl
HCl
>H2S
H2S
(填化学式).(2)E与F可形成E2F2的化合物,其化学式为
S2Cl2
S2Cl2
.(3)C、D形成的一种化合物能与D、E形成的化合物在溶液中发生氧化还原反应,其离子方程式为
Na2O2+S2-+2H2O=S↓+2Na++4OH-
Na2O2+S2-+2H2O=S↓+2Na++4OH-
.(4)A、C、E三种元素形成的一种常见化合物H,其浓溶液在加热条件下可与ag铜反应,则被还原的H的物质的量为
| a |
| 64 |
| a |
| 64 |
已知X、Y、Z为三种短周期元素,其中X的原子核中只有1个质子,X与Y原子的最外层电子数之和等于Z原子的最外层电子数,Z的-2价离子的电子层结构与氖的相同.
现有A、B、C、D、E五种中学化学中常见的化合物,转化关系如下所示.
A→B→C→D→E
涉及反应的所有反应物和产物均由X、Y、Z中的一种或几种元素组成.请回答:
(1)D的浓溶液能使蛋白质显黄色,由此可知D的化学式为
(2)E是一种离子化合物.在实验室中检验该物质所含阳离子的实验操作方法和现象为:取少量E放入试管中,加入少量NaOH溶液并加热,
(3)A生成B的反应是工业制取D的基础,该反应的化学方程式为
查看习题详情和答案>>
现有A、B、C、D、E五种中学化学中常见的化合物,转化关系如下所示.
A→B→C→D→E
涉及反应的所有反应物和产物均由X、Y、Z中的一种或几种元素组成.请回答:
(1)D的浓溶液能使蛋白质显黄色,由此可知D的化学式为
HNO3
HNO3
.(2)E是一种离子化合物.在实验室中检验该物质所含阳离子的实验操作方法和现象为:取少量E放入试管中,加入少量NaOH溶液并加热,
将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明存在NH4+离子
将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明存在NH4+离子
.(3)A生成B的反应是工业制取D的基础,该反应的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.在反应中若有1.25mol 电子发生转移,则参加反应的A的体积为
| ||
| △ |
5.6
5.6
L(标准状况).