摘要:12.在密闭容器中进行如下反应:mA(g)+nB(g)pC(g).反应经5 min达到平衡.测得此时A的浓度减小了a mol/L.而C的浓度增加了a mol/L.又知平均反应速率:v(C)=2v(B). (1)写出上述化学方程式中各物质的计量数:m= . n= . p= . (2)压强一定时.C的百分含量(C%)与温度.时间(T表示温度.t表示时间)的关系如右图所示. 由此可知.该反应为 反应. (3)该反应的平衡常数表示式为 ,升高温度.K值将 (填“增大 “减小 或“不变 ). 解析:(1)根据速率之比等于计量数之比.即m∶n∶p=3∶1∶2.故m=3, n=1, p=2. (2)由图象可知T1>T2.升温C%减小.平衡逆向移动.说明正反应为放热反应. (3)K=.升温K减小. 答案:放热 (3)K= 减小
网址:http://m.1010jiajiao.com/timu3_id_84245[举报]
在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )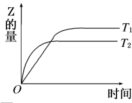

| A、T1<T2,正反应是放热反应 | B、T1<T2,正反应是吸热反应 | C、T1>T2,正反应是放热反应 | D、T1>T2,正反应是吸热反应 |
在密闭容器中进行如下反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
①平衡不发生移动 ②平衡沿着正反应方向移动 ③平衡沿着逆反应方向移动 ④NH3的质量分数增加 ⑤正逆反应速率都增大.
①平衡不发生移动 ②平衡沿着正反应方向移动 ③平衡沿着逆反应方向移动 ④NH3的质量分数增加 ⑤正逆反应速率都增大.
查看习题详情和答案>>