题目内容
在密闭容器中进行如下反应:N2+3H2?2NH3,若将平衡系中各物质的浓度都增大到原来的2倍,则产生的结果是( )
分析:首先分析化学反应的特征,反应前气体化学计量数之和大于反应后气体的化学计量数之和,增大压强,平衡向正反应方向移动;正反应放热,升高温度平衡向逆反应方向移动,若将平衡体系中各物质的浓度都增加到原来的2倍,则应缩小体积,增大了压强,则平衡向正反应方向移动.
解答:解:A、反应前后气体的化学计量数之和不相等,改变压强,平衡发生移动,故A错误;
B、若将平衡体系中各物质的浓度都增加到原来的2倍,则应缩小体积,增大压强,则平衡向正反应方向移动,故B正确;
C、平衡体系中各物质的浓度都增加到原来的2倍,则应缩小体积,增大压强,则平衡向正反应方向移动,故C错误;
D、浓度增大,正逆反应速率增大,故D错误;
故选B.
B、若将平衡体系中各物质的浓度都增加到原来的2倍,则应缩小体积,增大压强,则平衡向正反应方向移动,故B正确;
C、平衡体系中各物质的浓度都增加到原来的2倍,则应缩小体积,增大压强,则平衡向正反应方向移动,故C错误;
D、浓度增大,正逆反应速率增大,故D错误;
故选B.
点评:本题考查了化学平衡状态的影响因素,根据平衡移动原理进行分析,本题难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
在密闭容器中进行如下反应:X(g)+Y(g)?2Z(g),已知X、Y、Z的起始浓度分别为0.1mol/L、0.2mol/L、0.2mol/L,在一定条件下,达到平衡时,各物质的浓度不可能是( )
| A、Z为0.3 mol/L | B、Y为0.15 mol/L | C、X为0.1 mol/L | D、Z为0.4 mol/L |
在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )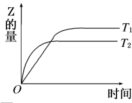

| A、T1<T2,正反应是放热反应 | B、T1<T2,正反应是吸热反应 | C、T1>T2,正反应是放热反应 | D、T1>T2,正反应是吸热反应 |
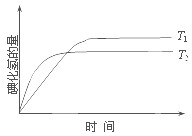 在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g);△H,在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )
在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g);△H,在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )