网址:http://m.1010jiajiao.com/timu3_id_83678[举报]
①配制浓度均为1 mol/L盐酸和醋酸溶液;
②用________量取10.00 mL 1 mol/L盐酸和醋酸溶液分别加入到两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为________;
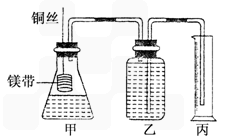
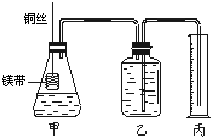
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录________;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应________,读出量筒中水的体积为V mL.
请将上述步骤补充完整并回答下列问题:
(1)用文字表述④检查该装置气密性的操作: ______________________.
(2)本实验中应选用________(填序号)的量筒.
A.100 mL B.200 mL C.500 mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm= ________.
(4)简述速率不等的原因 ___________________,铜丝不与酸接触的原因是_____________.
 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是
为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐,那么加入少量碳酸盐的作用是
Ⅱ.某研究性学习小组欲证明:在同温同压下,相同浓度、相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如右图所示.该实验的主要操作步骤如下:
①配制浓度均为1mol?L-1盐酸和醋酸溶液;
②量取15.00mL 1mol?L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录相关数据;
⑥反应结束后待温度恢复到室温,调整乙和丙中液面使二者处于同一平面,读出量筒中水的体积为V mL.
请你参与实验并回答下列问题:
(1)量取15.00mL 1mol?L-1盐酸和醋酸溶液所用的仪器是
A.带刻度的烧杯 B.量筒 C.酸式滴定管 D.碱式滴定管
(2)步骤③中a的数值至少是
(3)本实验装置丙中量筒的规格是
A.10mL B.100mL C.200mL D.500mL
(4)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=
(5)试简述速率不等的原因是
(6)试写出镁与醋酸溶液反应的离子方程式:
Ⅰ.(4分)铜与稀硝酸反应的离子方程式为________________;在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是________________;为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐,那么加入少量碳酸盐的作用是________________。
Ⅱ.某研究性学习小组欲证明:在同温同压下,相同浓度、相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol?L-1盐酸和醋酸溶液;
②量取15.00 mL 1 mol?L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录相关数据;
⑥反应结束后待温度恢复到室温,调整乙和丙中液面使二者处于同一平面,读出量筒中水的体积为V mL。
请你参与实验并回答下列问题:
(1)量取15.00 mL 1 mol?L-1盐酸和醋酸溶液所用的仪器是 ;
A.带刻度的烧杯 B.量筒 C.酸式滴定管 D.碱式滴定管
(2)步骤③中a的数值至少是 ;步骤④中检查该装置气密性的操作与观察方法是:____________________;步骤⑤中应记录的数据是 ;
(3)本实验装置丙中量筒的规格是 (填序号)。
A.10mL B.100 mL C.200 mL D.500 mL
(4) 若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=____;
(5)试简述速率不等的原因是_________;铜丝不与酸接触的原因是_______________。
(6)试写出镁与醋酸溶液反应的离子方程式: 。
查看习题详情和答案>>
①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.00 mL 1 mol·L-1的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为a g的镁条(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁条浸入酸中至反应完全;
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL。
请根据上述步骤回答下列问题:
(1)用文字表述步骤②中检查该装置气密性的方法:_____________________。
(2)量取10.00 mL1mol·L-1盐酸和醋酸溶液分别注入锥形瓶中时,所用的仪器是_________(填下列各项序号字母)。
A.50 mL量筒 B.10 mL量筒
C.25 mL酸式滴定管 D.25 mL碱式滴定管
(3)步骤④中,理论上称取的镁条质量不能少于_________ g。
(4)步骤⑤中需记录的数据是_______;实验过程中观察到的主要现象是______________。
(5)步骤⑥中,读取量筒中水的体积时若俯视读数,对计算该条件下的气体摩尔体积影响为_________(填“偏大”“偏小”或“无法确定”)。
(6)为保证实验顺利进行,仪器丙应选用的规格是_________(填序号字母)。
A.100 mL B.200 mL C.500 mL
(7)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为______ L·mol-1。
查看习题详情和答案>>(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]
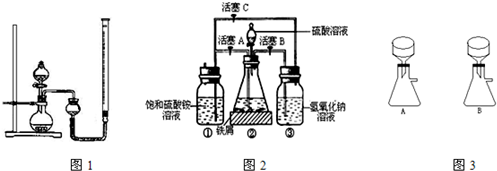
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
- 4 |
试求产品中摩尔盐的质量分数
