题目内容
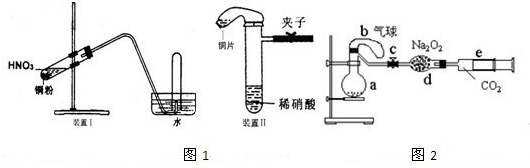
Ⅰ.(4分)铜与稀硝酸反应的离子方程式为________________;在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是________________;为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐,那么加入少量碳酸盐的作用是________________。
Ⅱ.某研究性学习小组欲证明:在同温同压下,相同浓度、相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol?L-1盐酸和醋酸溶液;
②量取15.00 mL 1 mol?L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录相关数据;
⑥反应结束后待温度恢复到室温,调整乙和丙中液面使二者处于同一平面,读出量筒中水的体积为V mL。
请你参与实验并回答下列问题:
(1)量取15.00 mL 1 mol?L-1盐酸和醋酸溶液所用的仪器是 ;
A.带刻度的烧杯 B.量筒 C.酸式滴定管 D.碱式滴定管
(2)步骤③中a的数值至少是 ;步骤④中检查该装置气密性的操作与观察方法是:____________________;步骤⑤中应记录的数据是 ;
(3)本实验装置丙中量筒的规格是 (填序号)。
A.10mL B.100 mL C.200 mL D.500 mL
(4) 若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=____;
(5)试简述速率不等的原因是_________;铜丝不与酸接触的原因是_______________。
(6)试写出镁与醋酸溶液反应的离子方程式: 。
Ⅰ.(4分)3Cu+8H++2NO![]() ==== 3Cu2++2NO↑+4H2O (2分) 试管内存在的空气将生成的NO氧化为NO2 (1分) 碳酸盐与硝酸的反应速率快,生成的CO2排走了试管内的空气(1分)
==== 3Cu2++2NO↑+4H2O (2分) 试管内存在的空气将生成的NO氧化为NO2 (1分) 碳酸盐与硝酸的反应速率快,生成的CO2排走了试管内的空气(1分)
Ⅱ.(12分)(1)C (1分)
(2)0.18或0.2;(2分) 两手掌紧贴锥形瓶外壁(或加热)一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气;(1分) 反应起止时间(1分)
(3)C (1分)
(4) V /1000×0.0075L?mol-1或VmL/1000mL?L-1×0.0075mol(2分)
(5)酸的浓度相同时,c(H+)不同;防止因形成原电池而干扰实验现象的观察(各1分)
(6)Mg+2CH3COOH=Mg2++2CH3COO―+H2↑(2分)


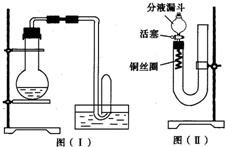 实验室用稀硝酸与Cu反应来制备NO,如果采用图(Ⅰ)装置,由于烧瓶内的空气不易排出,生成的NO很快被氧化成红棕色的NO2,不易观察到有无色的NO生成.即使可用排水法收集到无色的NO,也无说服力,会认为NO是由NO2与H2O反应生成的.有人设计了图(Ⅱ)装置,用来做该实验可以达到满意的效果.
实验室用稀硝酸与Cu反应来制备NO,如果采用图(Ⅰ)装置,由于烧瓶内的空气不易排出,生成的NO很快被氧化成红棕色的NO2,不易观察到有无色的NO生成.即使可用排水法收集到无色的NO,也无说服力,会认为NO是由NO2与H2O反应生成的.有人设计了图(Ⅱ)装置,用来做该实验可以达到满意的效果.